
ВВиОР 1 курс 2 сем. лабы / химия 2
.docxЛабораторная работа №2
Цель работы: Изучение процессов, протекающих при электрохимической коррозии металлов. Изучение способов защиты металлов от коррозии.
Ход работы
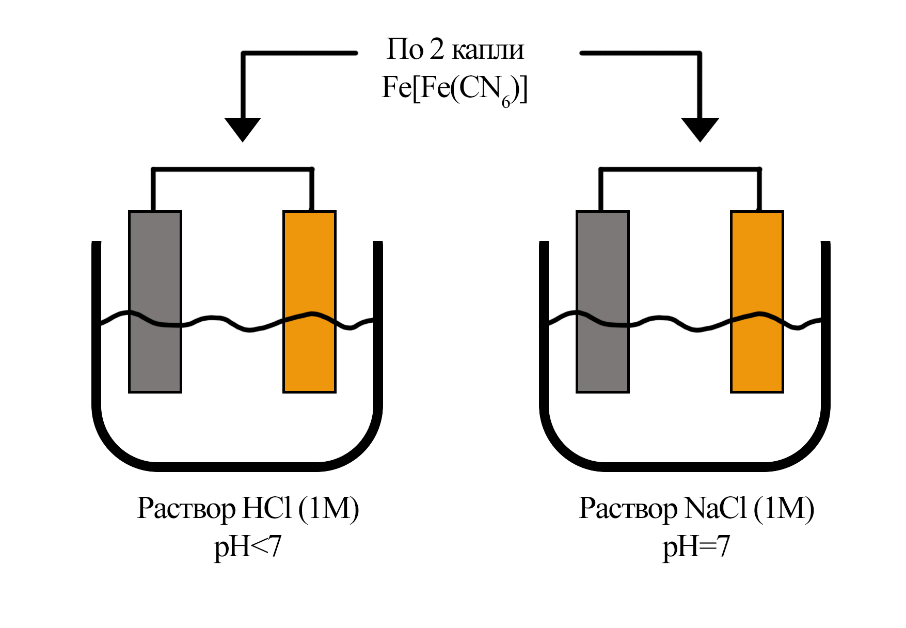
Опыт №1.
“Изучение процессов коррозии гальванической пары железо-медь в кислой и нейтральных средах”
3Fe2+ + 2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+6K+
Коррозию определили по появлению синей окраски в обоих растворах. Коррозия быстрее в кислой среде (р-р. HCl), как в более агрессивной.
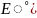
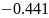
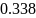
Анод Катод
Ок-е Восст-е
А (-): Fe -2е- = Fe2+
|
2 |
2 |
1 |
|
А (-): Fe -2е- = Fe2+
|
2 |
2 |
2 |
||||||
К (+): 2H+ +2e- =H2
|
2 |
1 |
|
CuК (+): 2H2O +O2 +4 e- =4OH-
|
4 |
1 |
||||||||
pH<7 (HCl) коррозия поляризации |
pH=7 (NaCl) окисление поляризации |
|||||||||||||
Fe +2H+ = Fe2++H2 |
2Fe+2H2O+O2=2Fe2++4OH- |
|||||||||||||
(-)Fe |
2H+ |
Cu(+) |
(-)Fe |
2H2O+O2 |
Cu(+) |
|
||||||||
Министерство образования Республики Беларусь
Учреждение образования
«Брестский Государственный Технический Университет»
Кафедра химии
Лабораторная работа №2
«Коррозии металлов»
Выполнил:
Студент 1-го курса
Группы В-11
---------------
Проверил(а):
------------------
Брест 2025
Опыт №2.
“Изучение влияния различной аэрации на коррозию поверхности стали, смоченной раствором электролита”
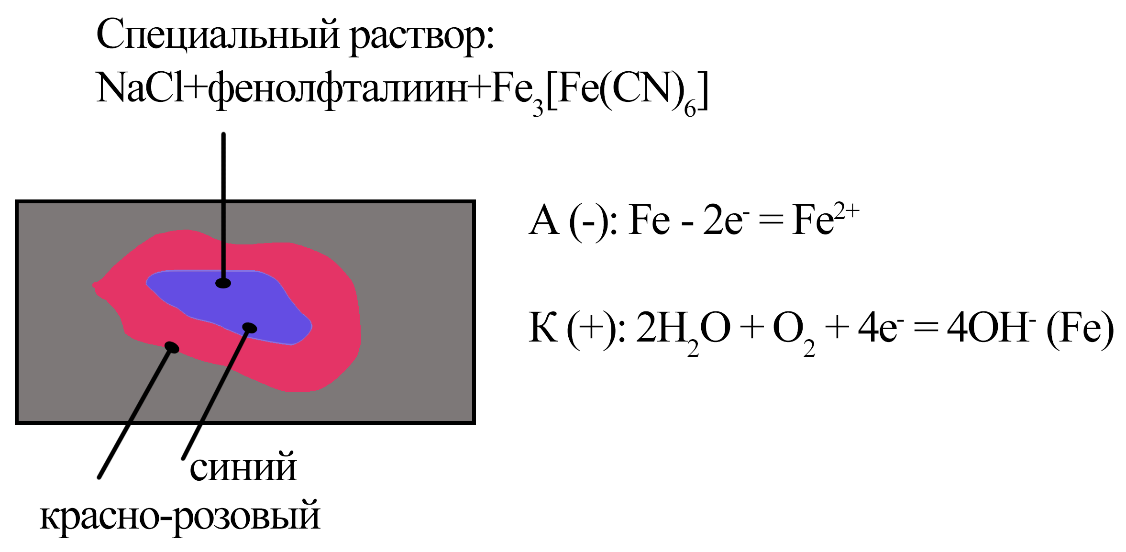
Так как центр капли окрасился в синий, железо, находящееся там окисляется (коррозирует).
В центре синий анод, а по краям красно-розовый катод. Анод собрался в центре из-за меньшего доступа к кислороду.

Анод Катод
Ок-е Восст-е
А (-): Fe -2е- = Fe2+
|
2 |
4 |
1 |
К (+): 2H2O + O2 + 4e- = 4OH-
|
2 |
1 |
Fe2+ + 2OH = Fe2(OH2)
-
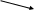 4Fe(OH)2
+ O2
+ 2H2O
= 4Fe(OH)3
4Fe(OH)2
+ O2
+ 2H2O
= 4Fe(OH)3 FeO3
FeO3n(H2O)
Опыт №3.
“Изучение процесса коррозии железа на поврежденном участке (дефекте) поверхности анодного и катодного защитного металлического покрытий”
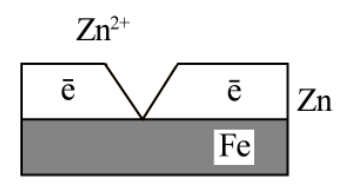
A(-) Zn |
H2O; O2 |
Fe K(+) |
Влага H2O+O2
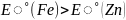 А
(-): Zn
-2е-
= Zn2+
А
(-): Zn
-2е-
= Zn2+
Катод Анод К (+): 2H+ + 2е- = H2
Восст-е Ок-е
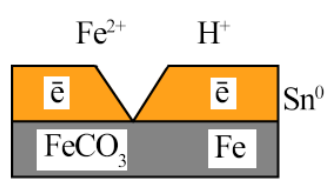
A(-) Fe |
H+ |
Sn K(+) |
Влага H2O+O2
А (-): Zn -2е- = Zn2+
Катод Анод К (+): 2H+ + 2е- = H2
Восст-е Ок-е
Покрытие из олова - катодное. Из цинка – анодное. При повреждении покрытия от коррозии защищает защитное анодное покрытие.
Опыт №4.
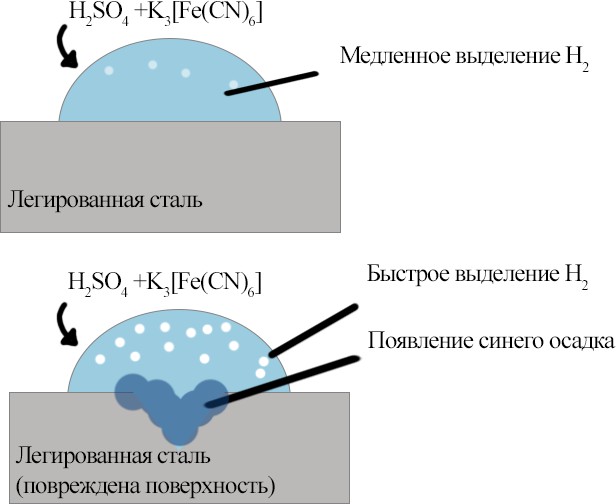 “Сравнительное
исследование
коррозионной
стойкости
обыкновенной
и легированной стали в кислой среде”
“Сравнительное
исследование
коррозионной
стойкости
обыкновенной
и легированной стали в кислой среде”
На нержавеющей реакция коррозии не проходит. Коррозия начнется при повреждении покрытия. То есть на поверхности легированной (нержавеющей) стали, на воздухе, образуется микропленка из оксидов, которая и защищает от коррозии.
Реакции, протекающие на стали с поврежденной поверхностью: Окисление железа: Fe → Fe2+ + 2e-
Реакция с серной кислотой: Fe+H2SO4 → FeSO4 + H2 ↑
Опыт №5.
“Изучение влияния ингибитора на скорость коррозии железа”
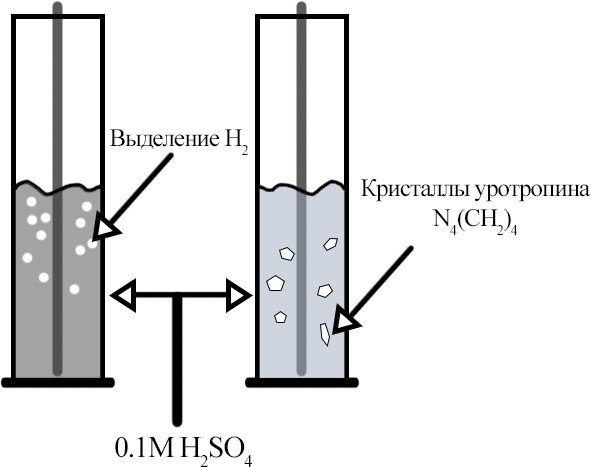 Уротропин
(N4(CH2)4)
замедляет
Уротропин
(N4(CH2)4)
замедляет
процесс коррозии, замедляя анодный процесс. В пробирке без него
наблюдается помутнение раствора и активное выделение пузырьков газа (водорода H2).
Без уротропина железо активно реагирует с серной кислотой:
Fe+H2SO4 → FeSO4 + H2 ↑
Вывод: Изучили процессы, протекающие при электрохимической коррозии металлов и способы защиты от коррозии.
