
ВВиОР 1 курс 2 сем. лабы / химия 1
.docxЛабораторная работа №1
Тема: Электрохимия, химические источники тока.
Цель работы: Изучение устройства и принципа работы гальванических элементов и процессов, происходящих при их эксплуатации.
Ход работы
Опыт №1. Определение ЭДС и напряжения гальванического элемента.
Методика определения:
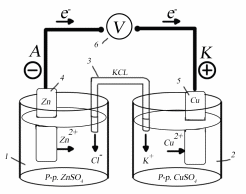
1. 1М раствор сульфата цинка (ZnSO4). 2. 1М раствор сульфата меди (CuSO4) 3. Солевой мостик, наполненный насыщенным раствором (KCI). 4. Цинковый электрод. 5. Медный электрод. 6. Вольтметр.
Результат:
Молярная концентрация растворов электролитов, моль/л |
Равновесные электродные потенциалы, В |
ЭДС элемента, В |
Напряжение элемента, В |
||||
[Cu2+] |
[Zn2+] |
E˚(Cu2+/Cu) |
E˚(Zn2+/ZN) |
ΔE |
Uсредн. |
||
1 |
1 |
+0,337 |
-0,763 |
1,1 |
0,8 |
||
ZNSO4 ➛ Zn2+ + SO4 [Zn2+] = [ZnSO4] = 1M
CuSO4 ➛Cu2+ + SO42- [Cu2+] = [CuSO4] = 1M
ΔE = Eк - Еа
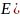
Определение анода и катода:
-0,763 +0,337
Анод Катод
Ок-е Восст-е
Уравнение электродных процессов:
А (-): Zn -2е- = Zn2+
|
2 |
2 |
1 |
К (+): Cu2+ +2e- =Cu
|
2 |
1 |
Уравнение токообразующей реакции:
Zna + Cuк2+ = Zna2+ + Cuк
Схема работы гальванического элемента:
-
➛
2e-
➛
(-) Zn
ZnSO4 (1M)
CuSO4 (1M)
Cu (+)
Уравнение ЭДС:
ΔE = 0,337 – (-0,763) = 1,1 В
Вывод: Возникшее напряжение меньше рассчитанного ЭДС так как на работу гальванического элемента влияет: материалы электродов и их чистота, концентрация электролитов, точность прибора, сопротивление прибора, поляризация элемента, омическое сопротивление и сопротивление проводников эл. тока.
Министерство образования Республики Беларусь
Учреждение образования
«Брестский Государственный Технический Университет»
Кафедра химии
Лабораторная работа №1
«Электрохимия, химические источники тока»
Выполнил:
Студент 1-го курса
Группы В-11
--------------
Проверил(а):
---------------
Брест 2025
