
Цели: Провести конформационный поиск для предложенных и индивидуального соединений. Смоделировать поведение молекул методом МД.
Ацетилсалициловая кислота:
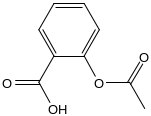
1) Торсионный угол (0 градусов)
Энергия 14,5671 ккал/моль

При изменении торсионного угла, энергия не изменилась. Молекула в данной конформации устойчива.
2) торсионный угол 11,1 градусов
Энергия 14,5050 ккал/моль
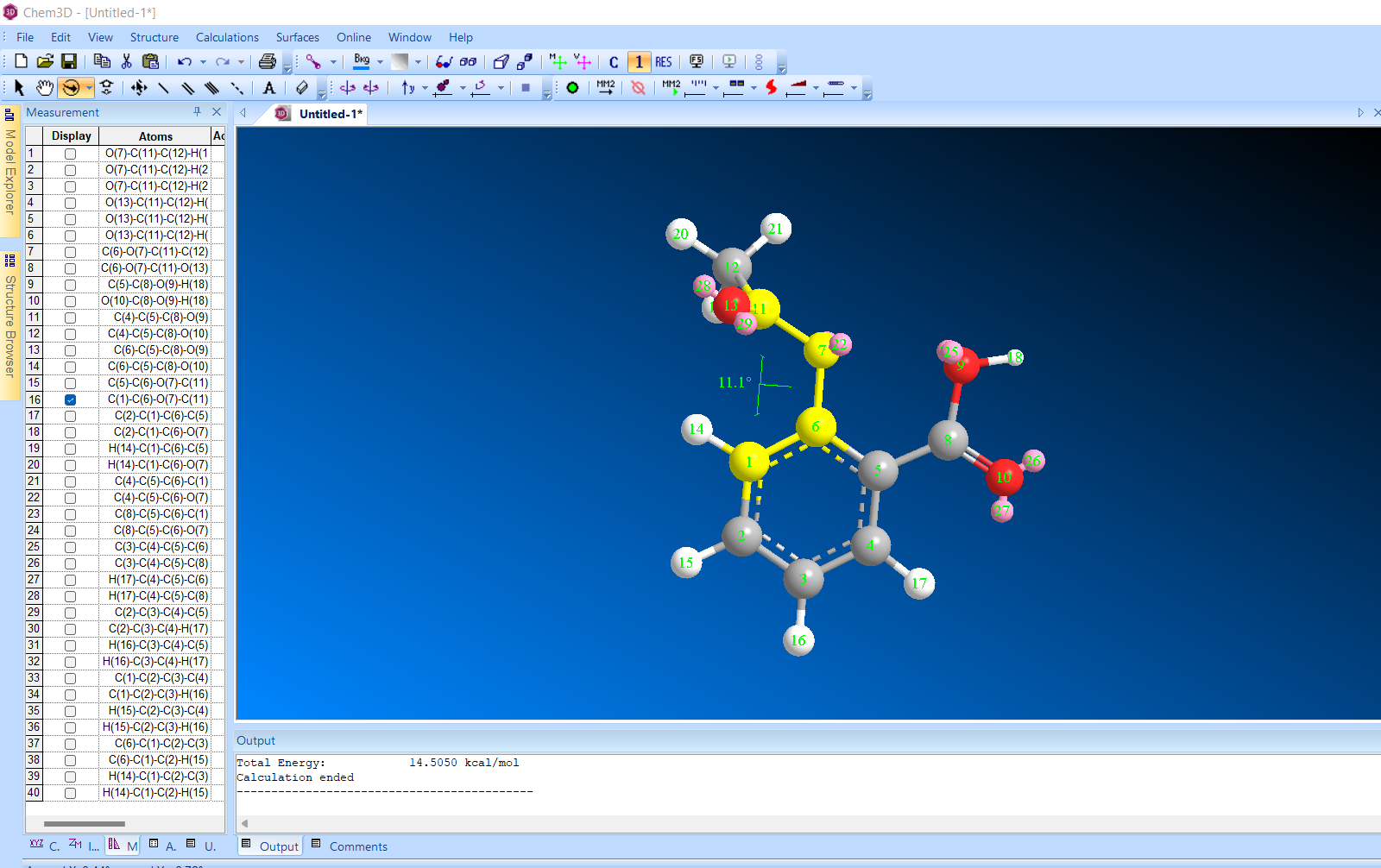
При изменении торсионного угла, энергия не изменилась. Молекула в данной конформации устойчива.
Фенол:
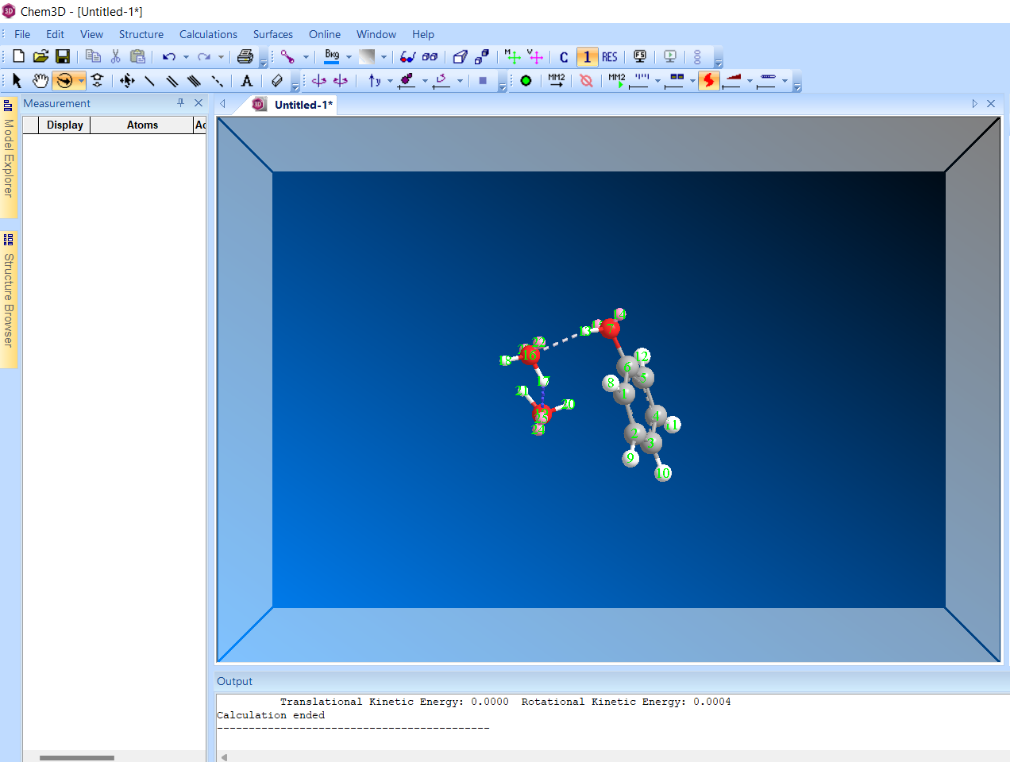
Результат расчета МД с водородными связями
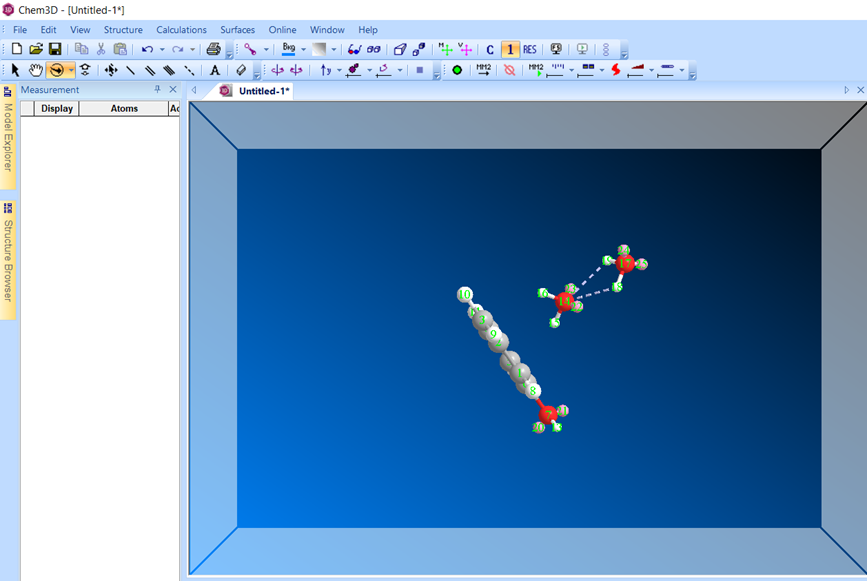
Результат оптимизации геометрии системы фенол-вода после последовательного использования МД и ММ+.
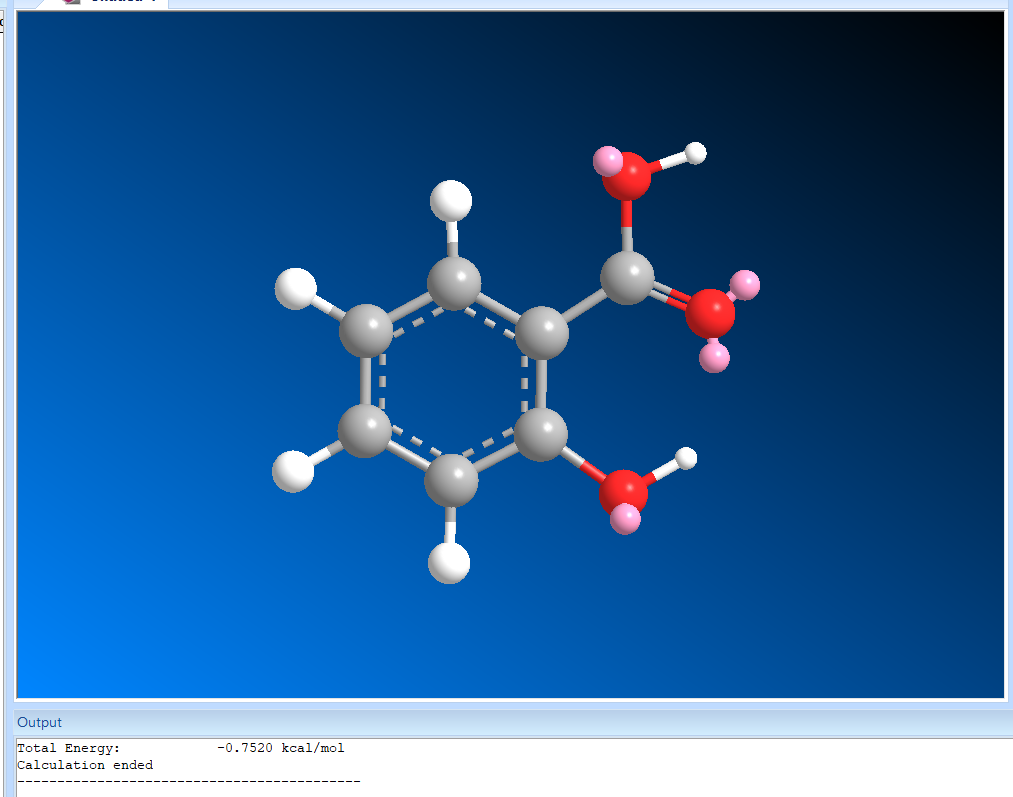
Салициловый альдегид:
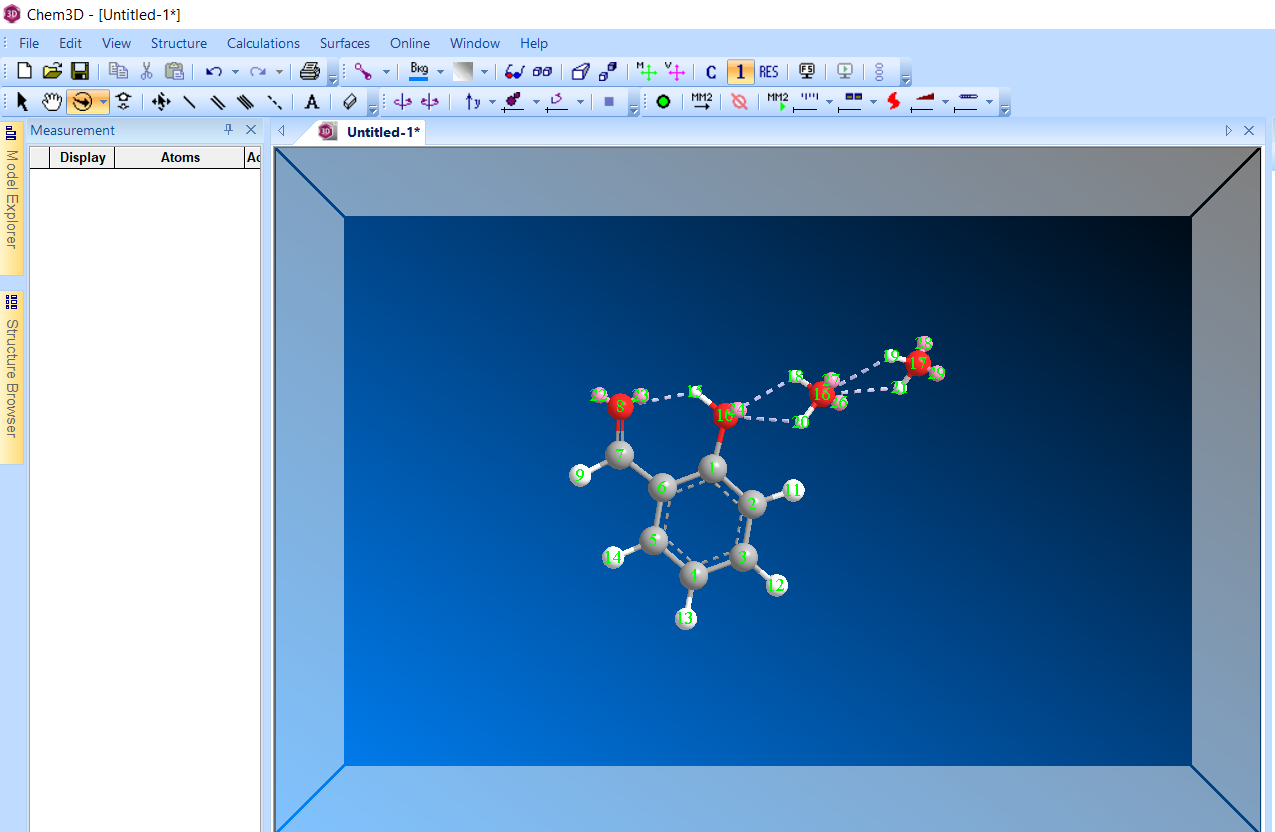
Молекула после оптимизации ММ
Энергия: -13.851 ккал/моль
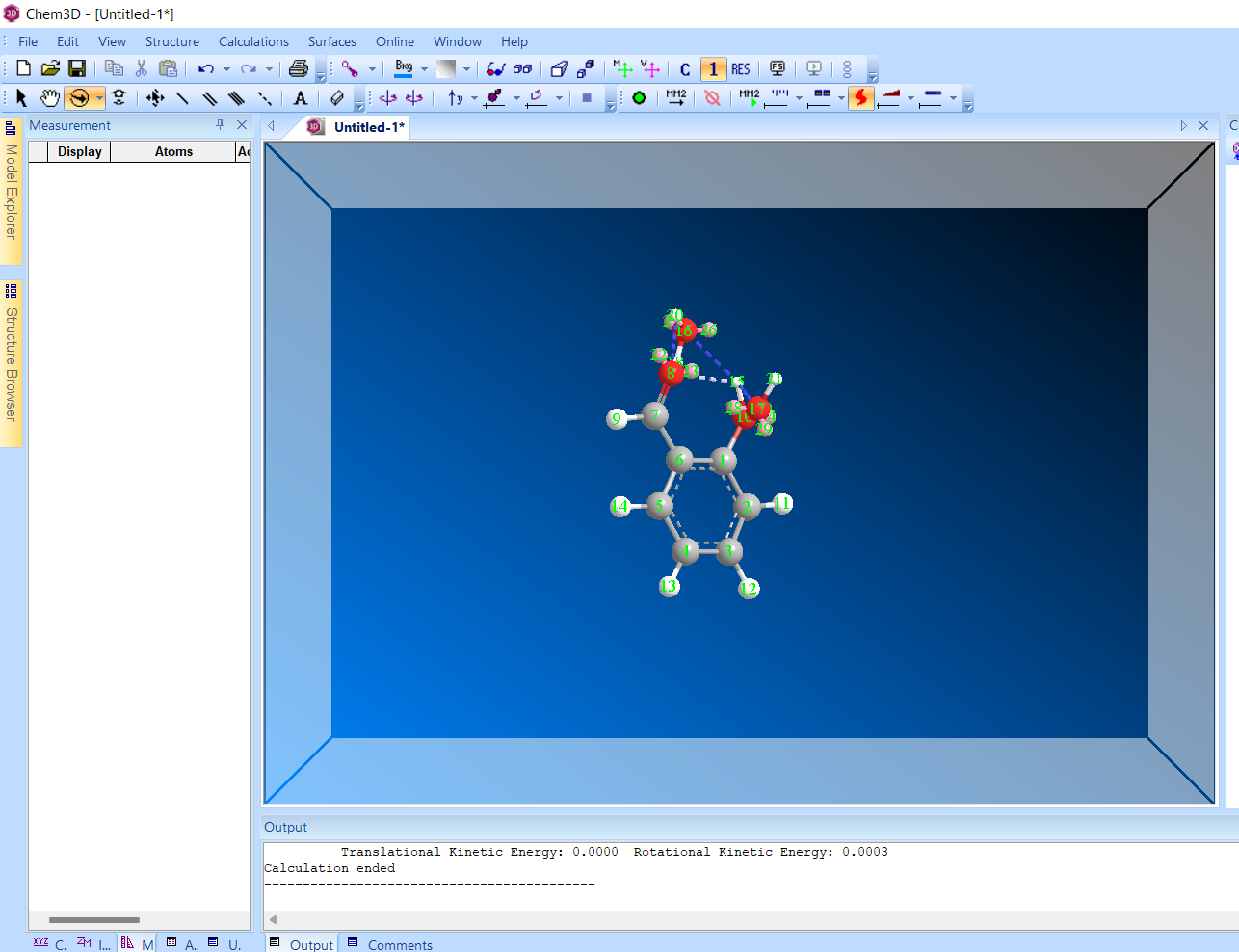
Молекула после оптимизации ММ+МД
Энергия: -29.453 ккал/моль

Молекула после оптимизации ММ+МД+ММ
Энергия: -26.6986 ккал/моль.
Салициловый альдегид с 6 молекулами воды
Энергия: -33.538 ккал/моль.
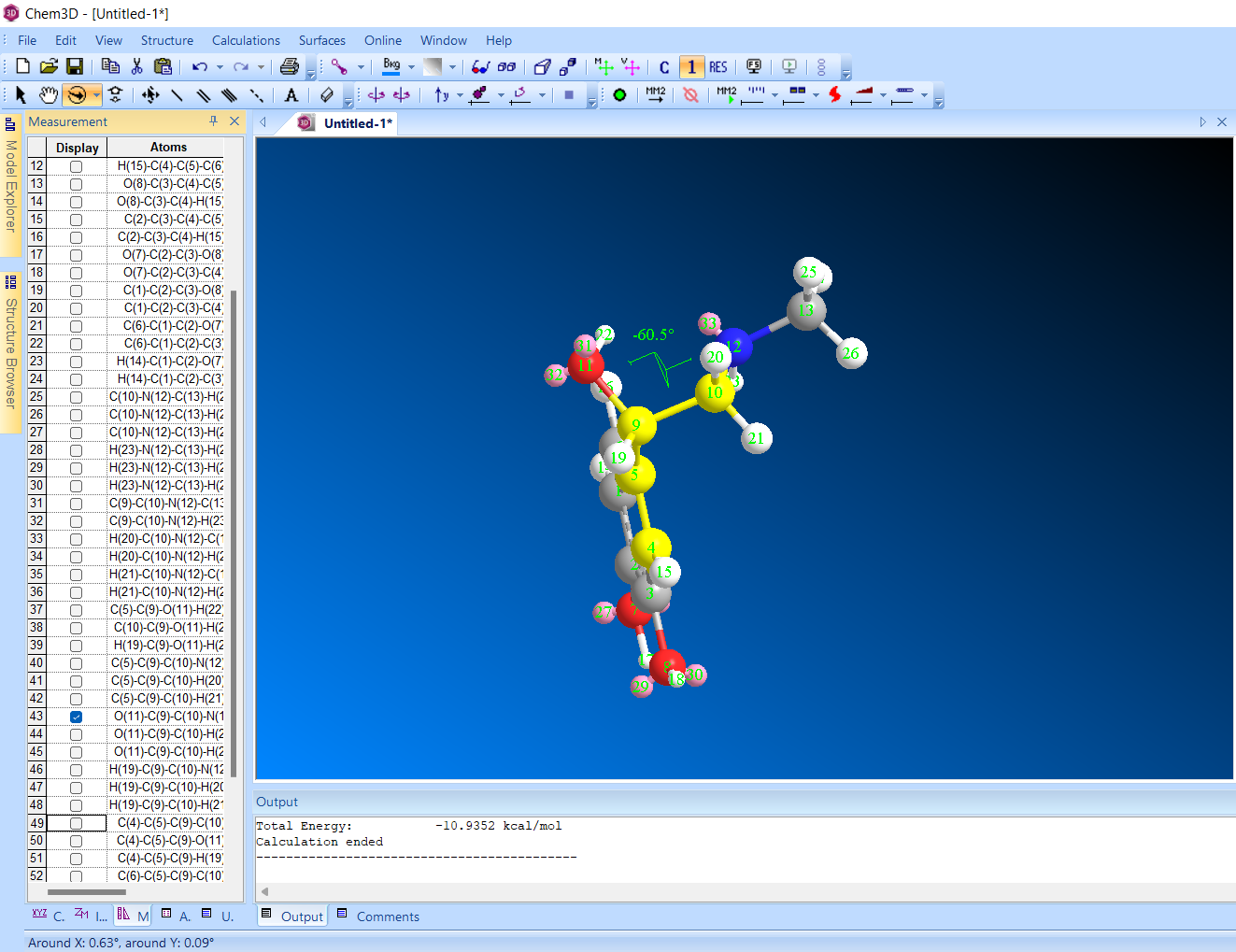
В-2
1 торсионный угол 30 градусов
Энергия -10,9354 ккал/моль

60 градусов
Энергия: -10,9552 ккал/моль

-150 градусов
Энергия: -10,7721 ккал/моль
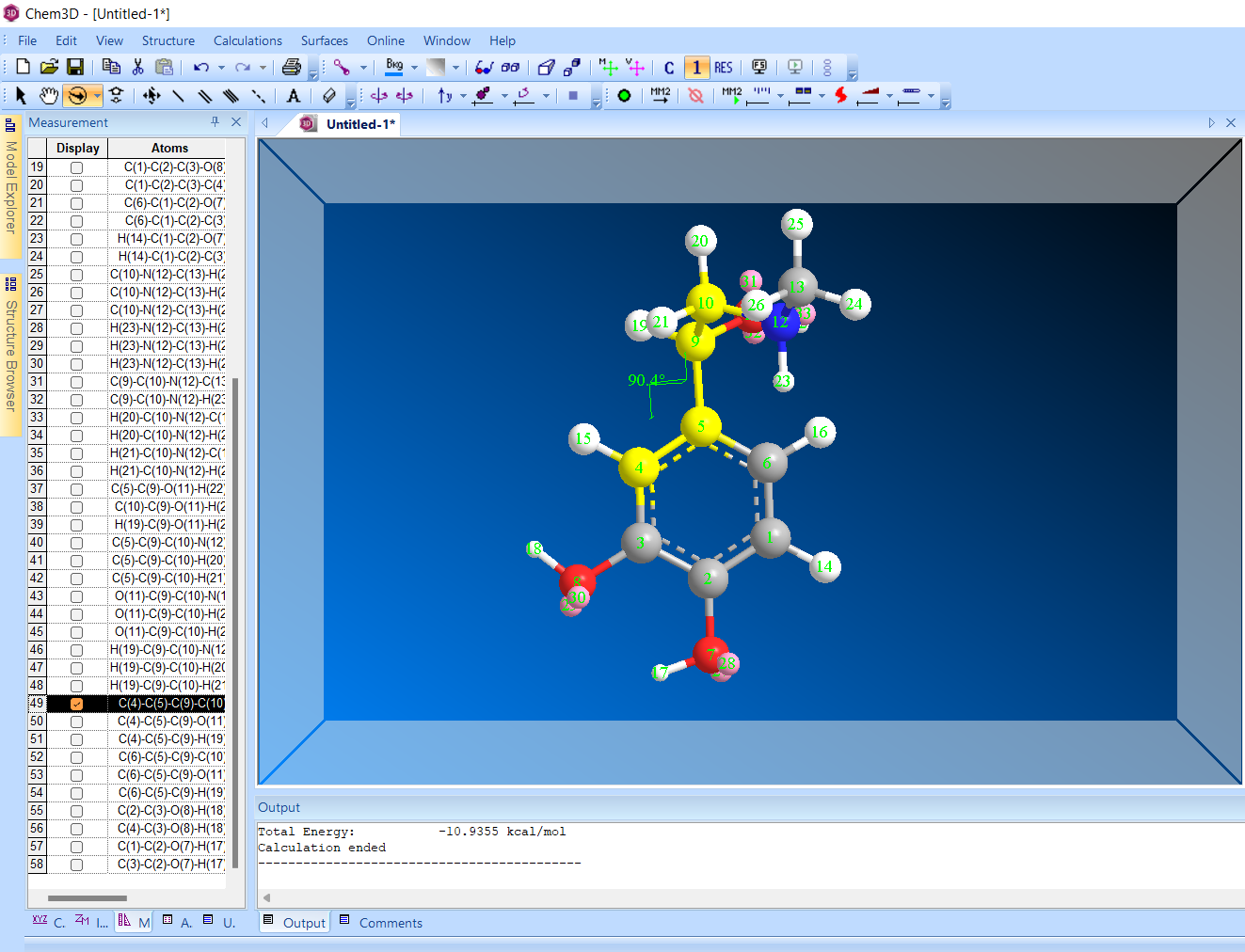
2)Торсионный угол 90 градусов.
Энергия: -10,9355 ккал/моль
-150 градусов
Энергия: -9,412 ккал/моль
Молекула после оптимизации ММ.
Наиболее выгодная геометрия системы получается за счёт водородных связей между молекулами воды.
Молекула после оптимизации МД.
Вывод: Входе лабораторной работы проведен конформационный поиск для предложенных (ацетилсалициловая кислота) и индивидуального соединений. Смоделировать поведение молекул(фенол, саллициловый альдегид) и индивидуального соединения методом МД с участием ММ.
Цели: Выполнить поиск данных по ферменту амилаза(7ТАА).
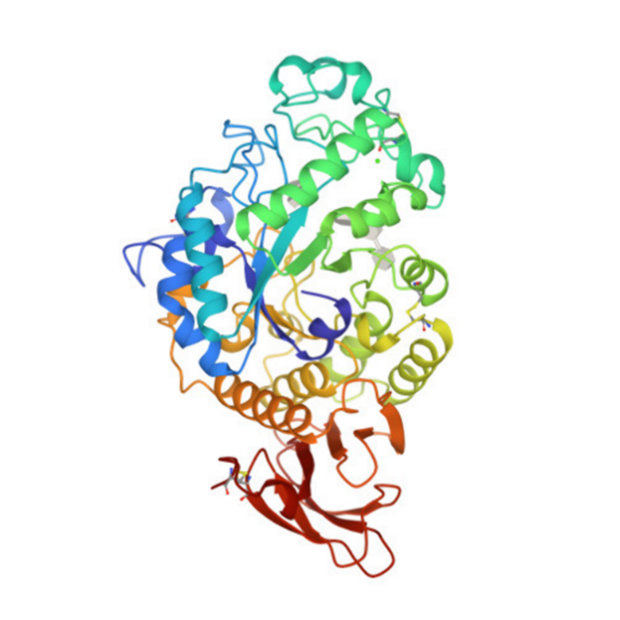
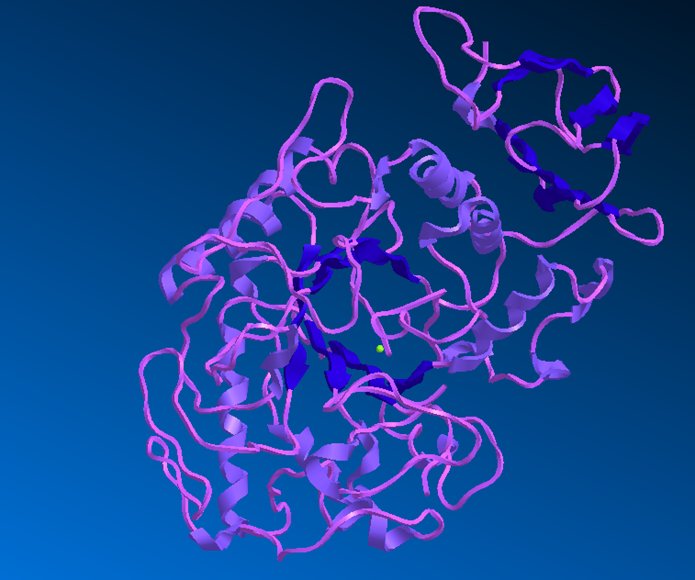
А Б
Рис.1 Структура 7ТАА
А – структура из PDB; Б – открытая в Chem3D
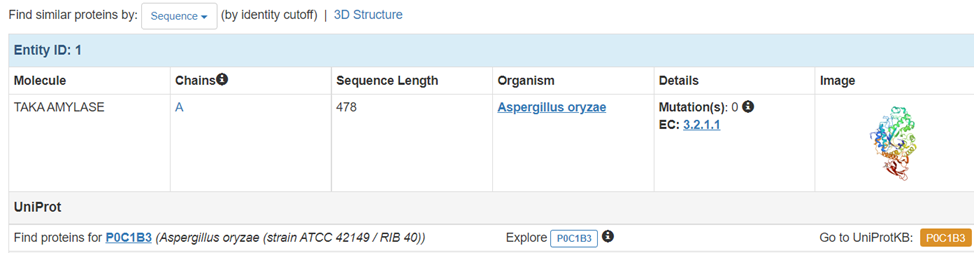
1)Метод установления структуры комплекса белка с ингибитором – x-ray diffraction (Рентгеноструктурный анализ)
В ходе рентгеноструктурного анализа исследуемый образец помещают на пути рентгеновских лучей и регистрируют дифракционную картину, возникающую в результате взаимодействия лучей с веществом. На следующем этапе исследования анализируют дифракционную картину и расчётным путём устанавливают взаимное расположение частиц в пространстве, вызвавшее появление данной картины.
2)Геометрия была установлена с точностью 1,98 А
3) Белок получен из организма Aspergillus oryzae
4) Число аминокислотных остатков 478
Первичная стрктура
>7TAA_1|Chain A|TAKA AMYLASE|Aspergillus oryzae (5062)
ATPADWRSQSIYFLLTDRFARTDGSTTATCNTADQKYCGGTWQGIIDKLDYIQGMGFTAIWITPVTAQLPQTTAYGDAYHGYWQQDIYSLNENYGTADDLKALSSALHERGMYLMVDVVANHMGYDGAGSSVDYSVFKPFSSQDYFHPFCFIQNYEDQTQVEDCWLGDNTVSLPDLDTTKDVVKNEWYDWVGSLVSNYSIDGLRIDTVKHVQKDFWPGYNKAAGVYCIGEVLDGDPAYTCPYQNVMDGVLNYPIYYPLLNAFKSTSGSMDDLYNMINTVKSDCPDSTLLGTFVENHDNPRFASYTNDIALAKNVAAFIILNDGIPIIYAGQEQHYAGGNDPANREATWLSGYPTDSELYKLIASANAIRNYAISKDTGFVTYKNWPIYKDDTTIAMRKGTDGSQIVTILSNKGASGDSYTLSLSGAGYTAGQQLTEVIGCTTVTVGSDGNVPVPMAGGLPRVLYPTEKLAGSKICSSS
5) Структура Лиганда

Аминокислотные остатки белка, участвующие в связывании лиганда:
Y256
G234
D233
D235
L232
Е230
К209
R204
T207
V119
H122
L166
Y82
W83
H80
D297
H296
D168
Y75
P341
D340
Q35
6) Белок относят к классу гидролаз, что говорит о том, что он катализирует реакции расщепления химических связей различных типов в органических молекулах. Гидролитические ферменты используются преимущественно в начальной, наиболее трудоемкой стадии переработки органического сырья, когда необходимо расщепить структурные или запасные полимеры, фрагменты
которых далее подвергаются трансформации под действием ферментов других классов.
Вывод: Входе лабораторной работы проведен анализ предложенной молекулы амилазы с помощью сайта https://www.wwpdb.org/. Найден источник белка, метод, которым он был определён, число аминокислотных остатков и его первичная структура, определены аминокислоты, связывающие белок с лигандом.
Цели: смоделировать третичную структуру белка, взяв первичную структуру с сайта https://www.ncbi.nlm.nih.gov. Сравнить сходство полученной модели амилазы с известными структурами других организмов.
Первичная структура, выбранной амилазы.
>KAF4006018.1 Alpha amylase, catalytic domain family protein [Saccharomyces cerevisiae]
MIISNVHQTKVVERGHNLSNYPASFKDSNNDGWGDLKGITSKLQYIKDLGVDAIWVCPFYDSPQQDMGYD
ISNYEKVWPTYGTNEDCFELIDKTHKLGMKFITDLVINHCSTEHEWFKESRSSKTNPKRDWFFWRPPKGY
DAEGKPIPPNNWKSFFGGSAWTFDETTNEFYLRLFASRQADLNWENEDCRRAIFESAVGFWLDHGVDGFR
IDTAGLYSKRPGLPDSPIFDKTSKLQHPNWGSHNGPRIHEYHQELHRFMKNRVKDGREIMTVGEVAHGSD
NALYTSAARYEVSEVFSFTHVEVGTSPFFRYNYWATTYIENHDQARSITRFADDSPKYRKISGKLLTLLE
CSLTGTLYVYQGQEIGQINFKEWPIEKYEDVDVKNNYEIIKKSFGKNSKEMKDFFKGIALLSRDHSRTPM
PWTKDKPNAGFTGPDVKPWFFLNESLSKESMLSRNPEMMTHDQIFSFTKEYEDKTLFAALNFSGEEIEFS
LPREGASLSFILGNYDDTDVSSRVLKPWEGRIYLVK
Наиболее схожие по структуре белки
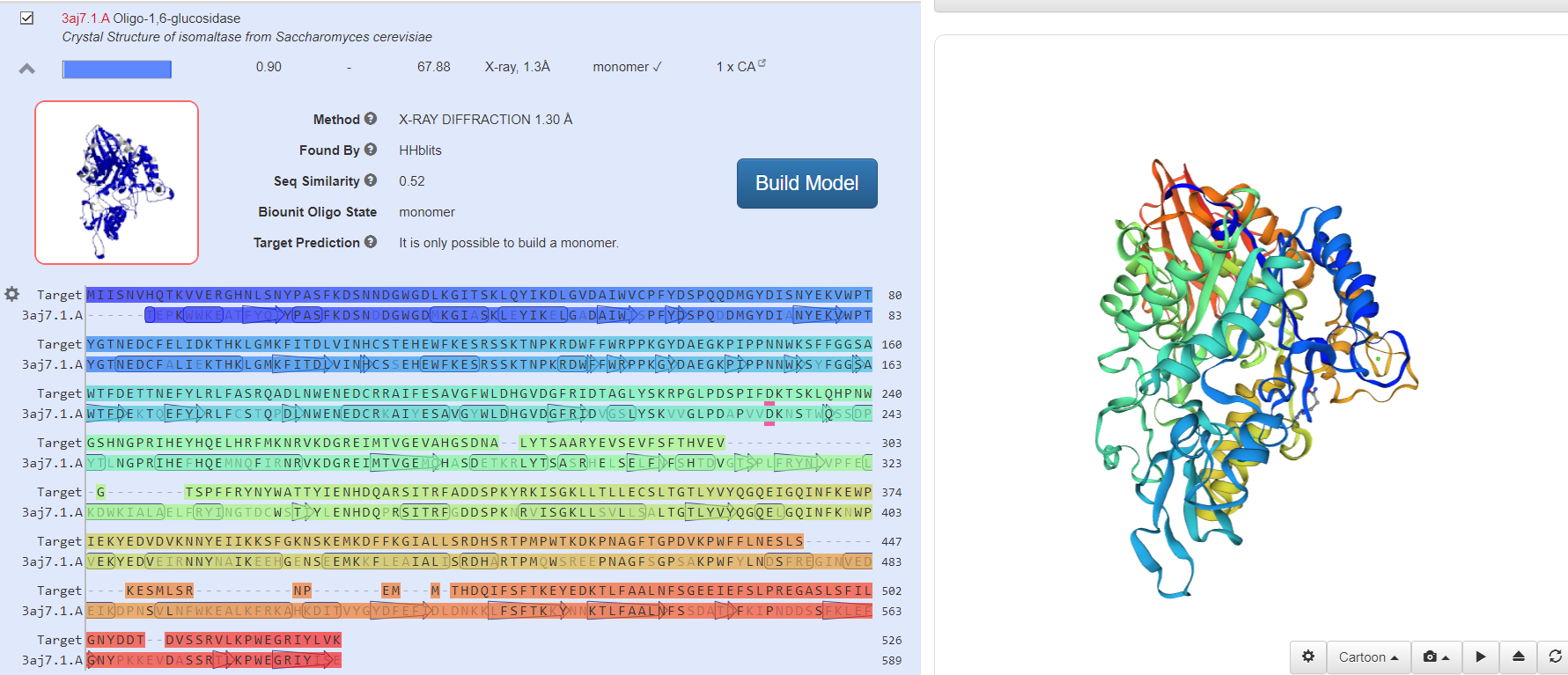
Модель выбранного белка после «Build Model»

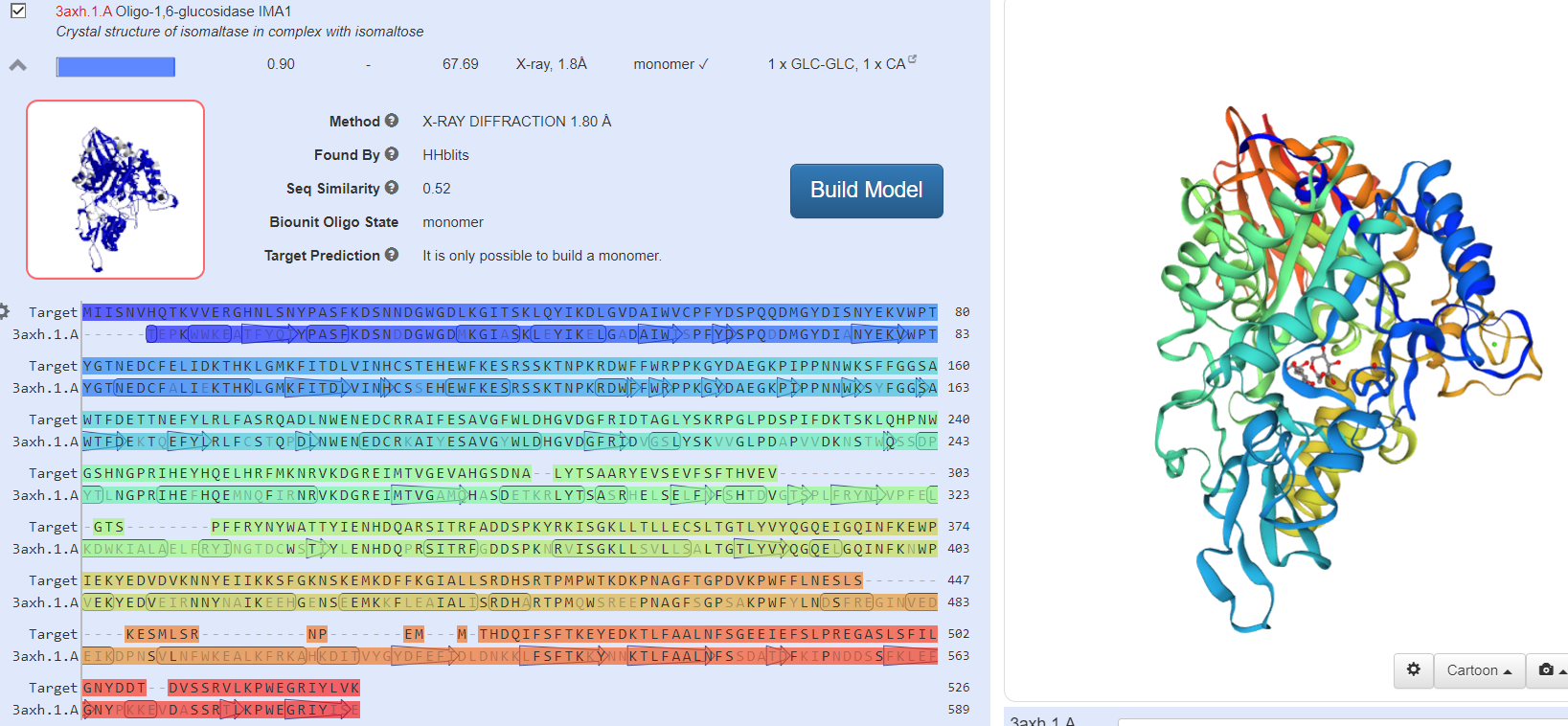
Модель выбранного белка после «Build Model»

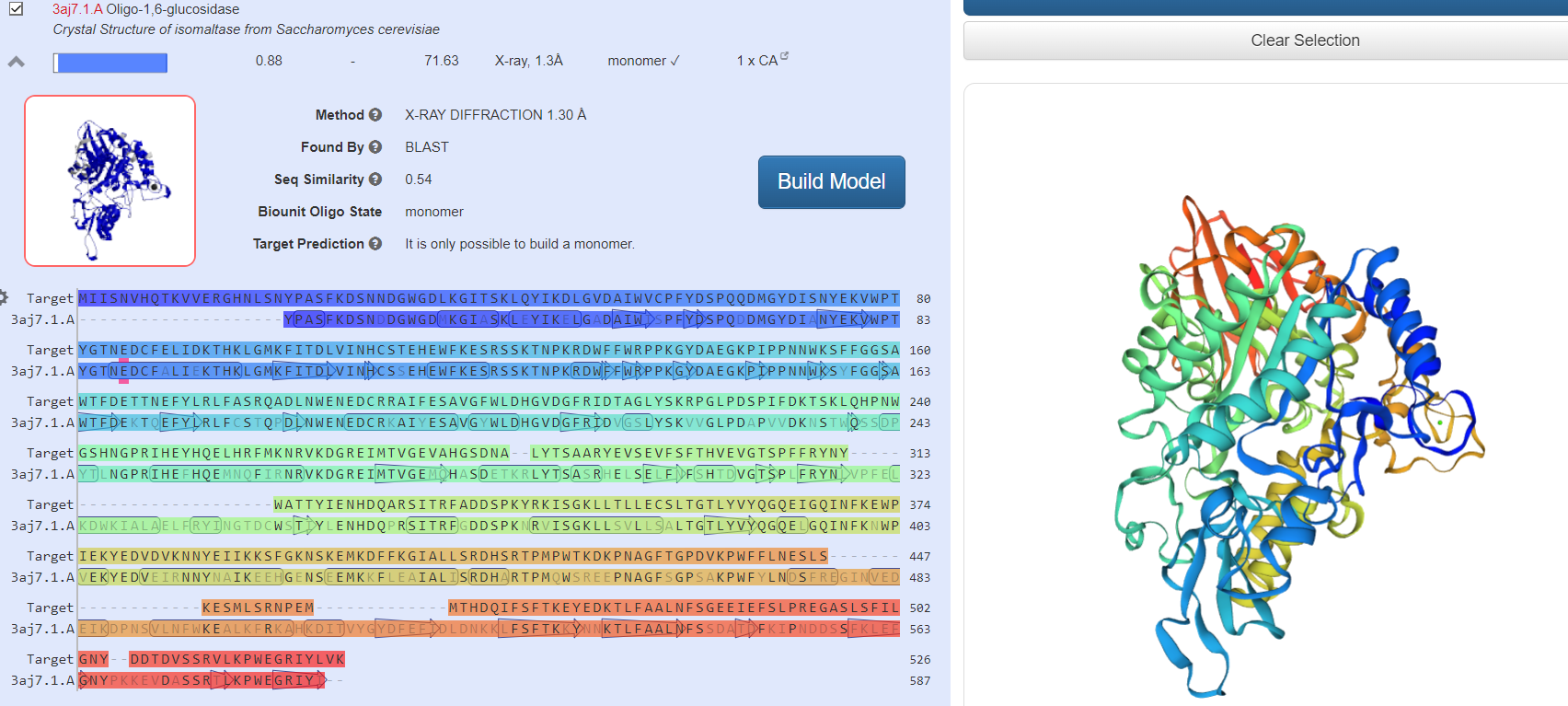
Модель выбранного белка после «Build Model»

Вывод: Входе лабораторной работы смоделировали третичную структуру белка, взяв первичную структуру с сайта https://www.ncbi.nlm.nih.gov. Сравнили сходство полученной модели амилазы с известными структурами других организмов. Структуры полученных белков имеют высокое сходство с изначально выбранными образцами.
Цели: произвести предсказание по связыванию с мишенями БАВ
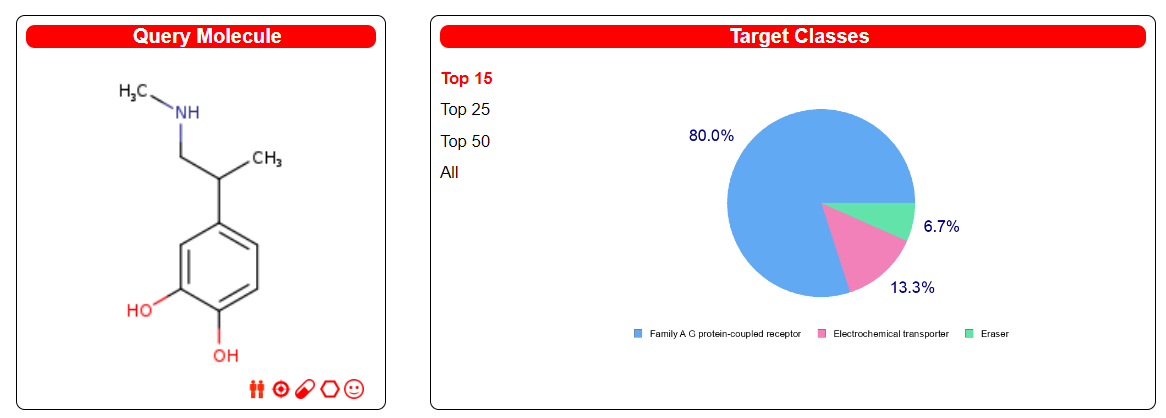

Ген DRD2 — дофаминовый рецептор D2
Этот ген кодирует подтип D2 дофаминового рецептора. Этот рецептор, связанный с G-белком, ингибирует активность аденилатциклазы. Миссенс-мутация в этом гене вызывает миоклонусную дистонию; другие мутации были связаны с шизофренией. Альтернативный сплайсинг этого гена приводит к двум вариантам транскриптов, кодирующим разные изоформы. Описан третий вариант, но не установлено, является ли эта форма нормальной или обусловлена аберрантным сплайсингом.
Лекарства и клинические кандидаты
Ген DRD3 - дофаминовый рецептор D3
Этот ген кодирует подтип D3 пяти (D1-D5) дофаминовых рецепторов. Активность рецептора подтипа D3 опосредована G-белками, которые ингибируют аденилатциклазу. Этот рецептор локализован в лимбических областях мозга, связанных с когнитивными, эмоциональными и эндокринными функциями. Генетическая вариация в этом гене может быть связана с предрасположенностью к наследственному эссенциальному тремору. Альтернативный сплайсинг этого гена приводит к вариантам транскриптов, кодирующим разные изоформы, хотя некоторые варианты могут подвергаться нонсенс-опосредованному распаду .
Лекарства и клинические кандидаты
Ген DRD4 — дофаминовый рецептор D4
Этот ген кодирует подтип D4 дофаминового рецептора. Подтип D4 представляет собой рецептор, связанный с G-белком, который ингибирует аденилатциклазу. Это мишень для препаратов, лечащих шизофрению и болезнь Паркинсона. Мутации в этом гене связаны с различными поведенческими фенотипами, включая дисфункцию вегетативной нервной системы, синдром дефицита внимания/гиперактивности и личностную черту поиска новизны. Этот ген содержит полиморфное количество (2-10 копий) тандемных 48-нуклеотидных повторов; показанная последовательность содержит четыре повтора.
Лекарства и клинические кандидаты
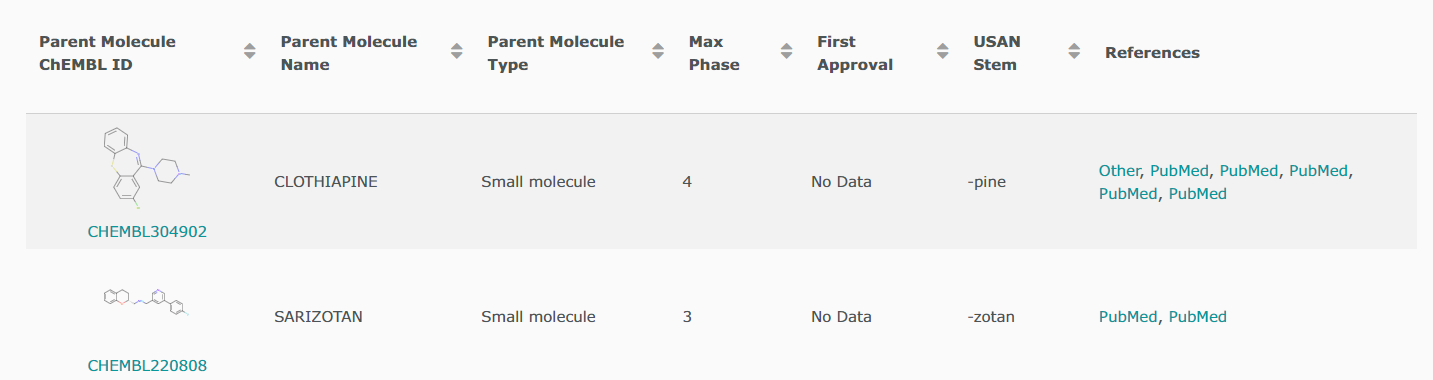
Цели: Найти какое-либо соединение с известными экспериментальными данными по липофильности и растворимости.
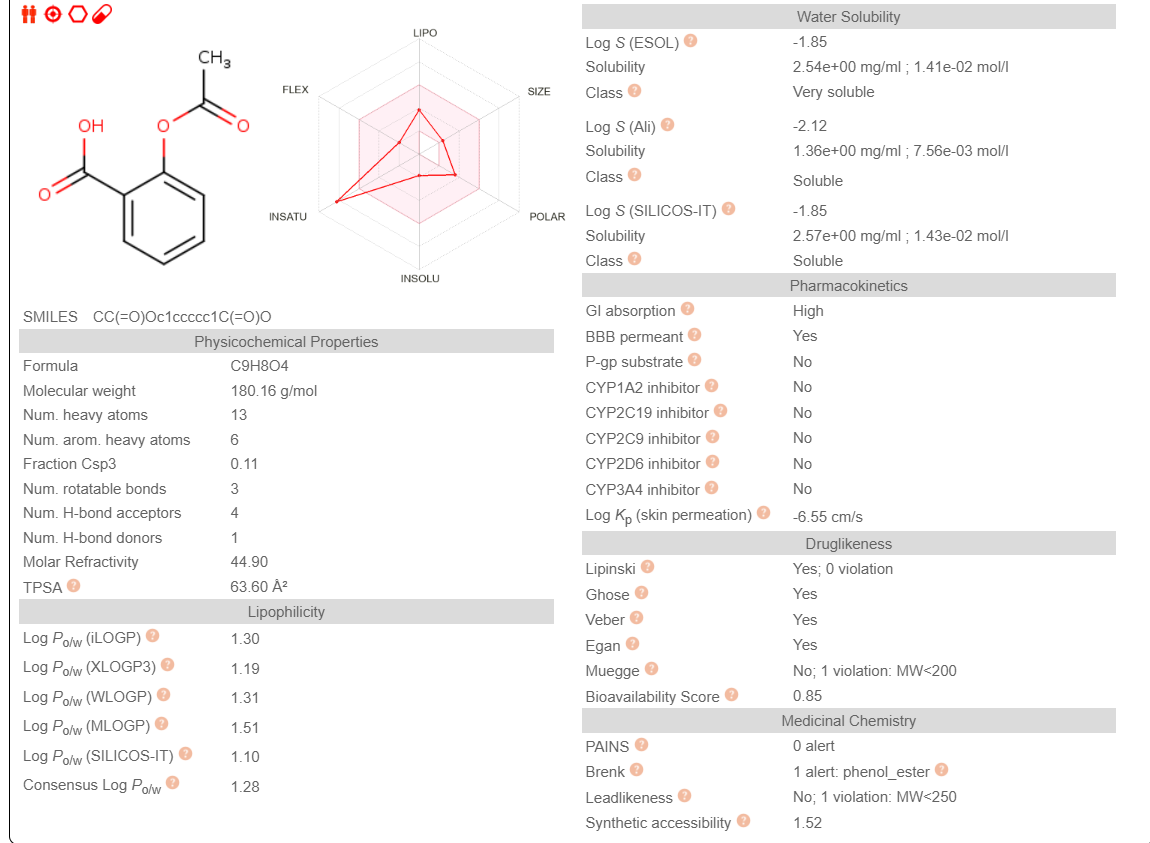
Известные данные:
Липофильность – LogP =1,2
Растворимость в воде – 3мг/мл
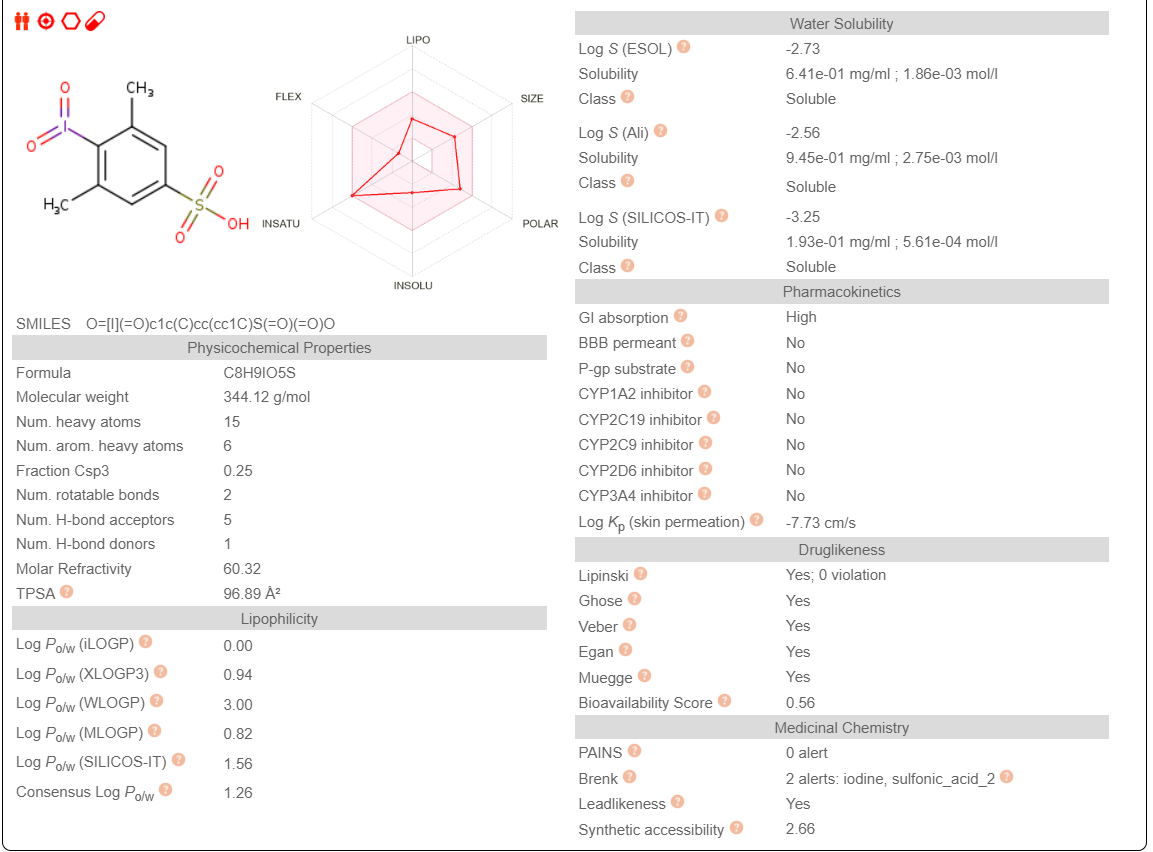
Различие в липофильности можно объяснить наличием -SO3H группы и йода.
Вывод: Входе лабораторной работы способна приблизительно предсказать липофильность введенного вещества на основе его структуры.
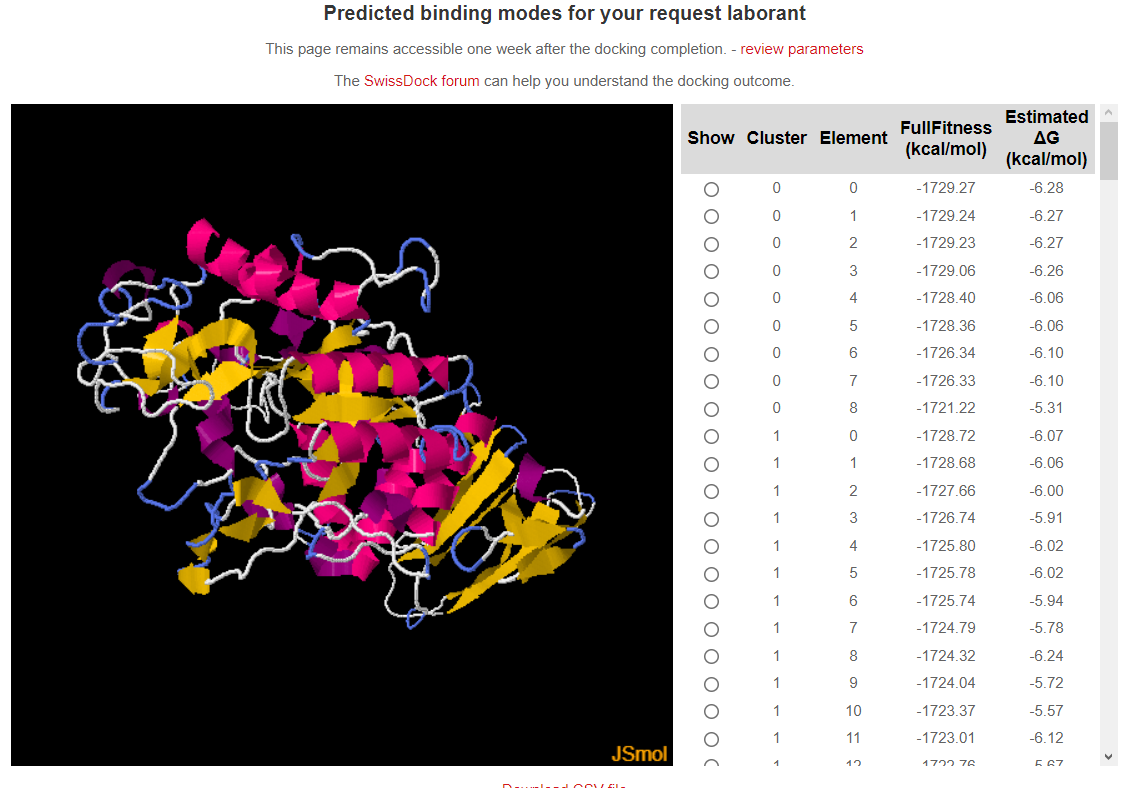
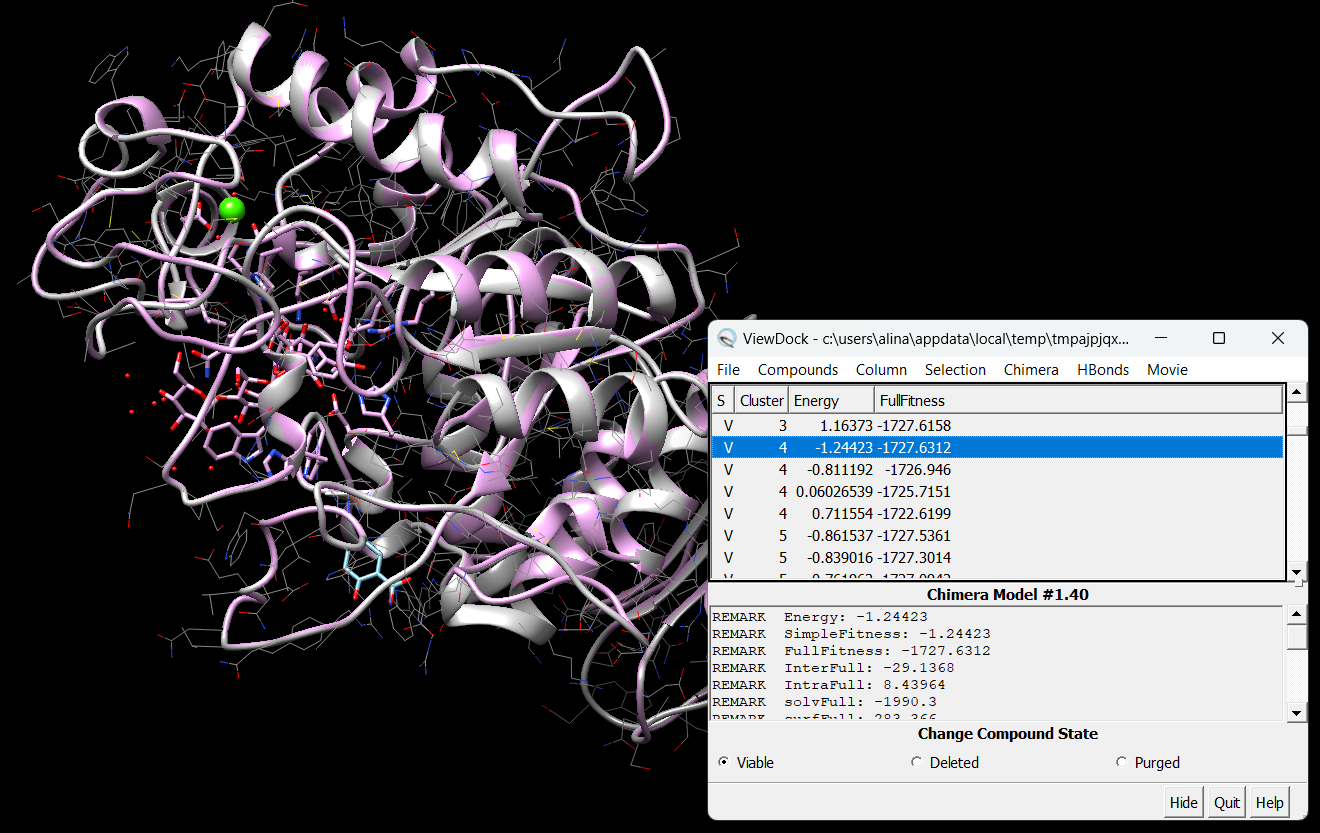
Цели: Провести докинг амилазы с салициловой кислотой с помощью интернет-ресурса SwissDock.
Результат докинга на сайте SwissDock.
Результат в программе Chimera
Результат после объединения амилазы с акарбозой
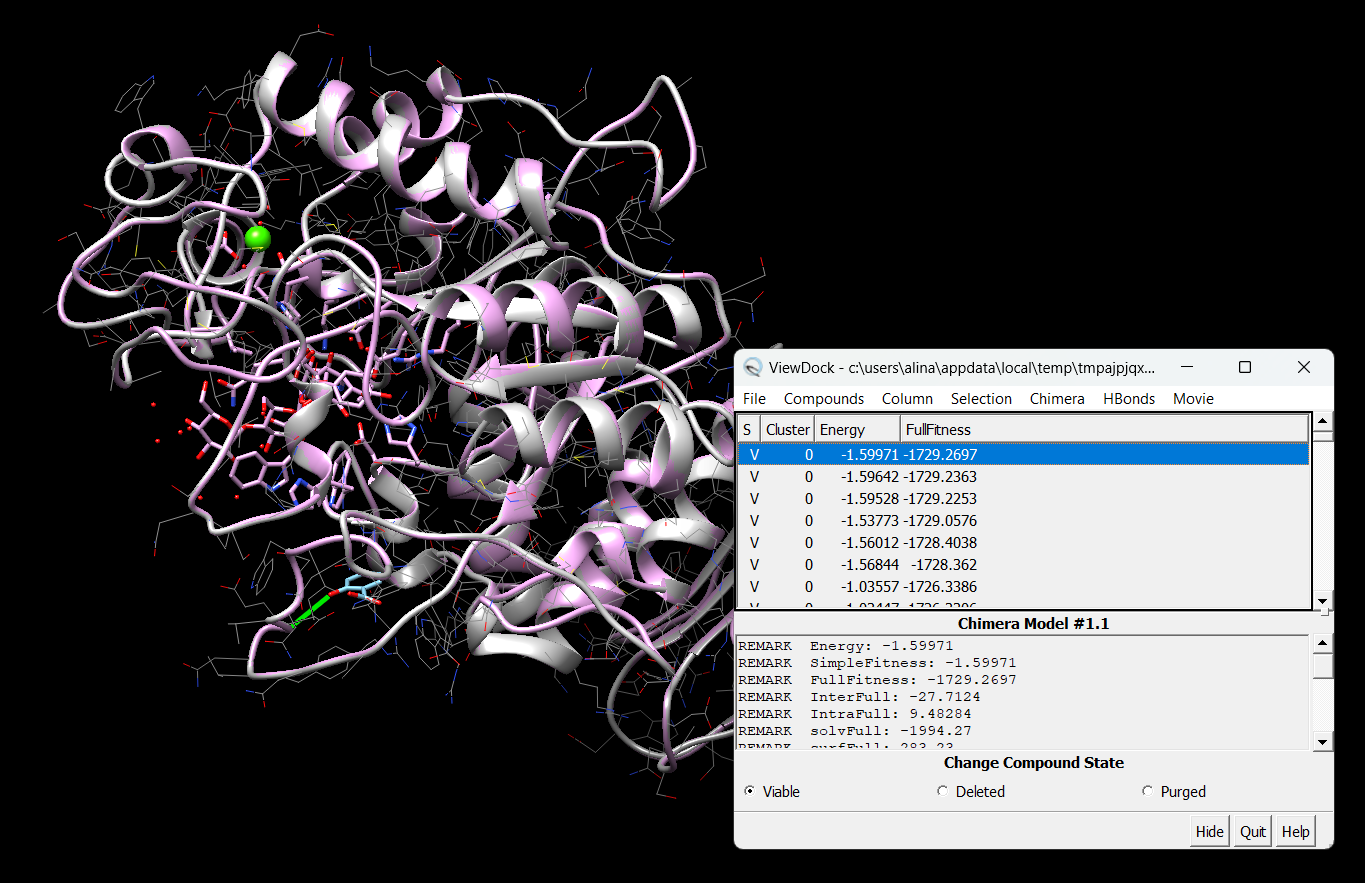
∆G = -6.698 кДж/моль
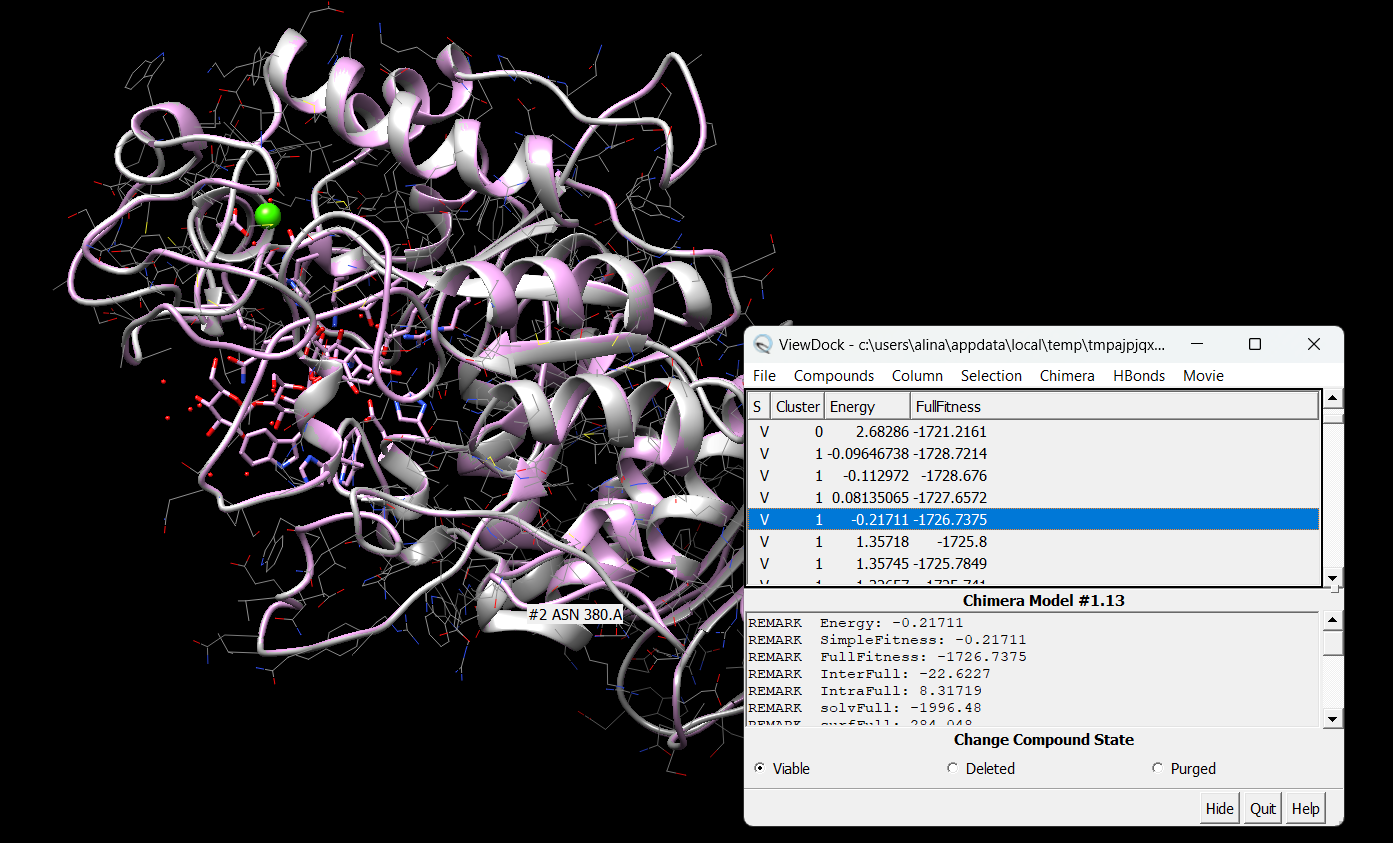
∆G = -0.9 кДж/моль
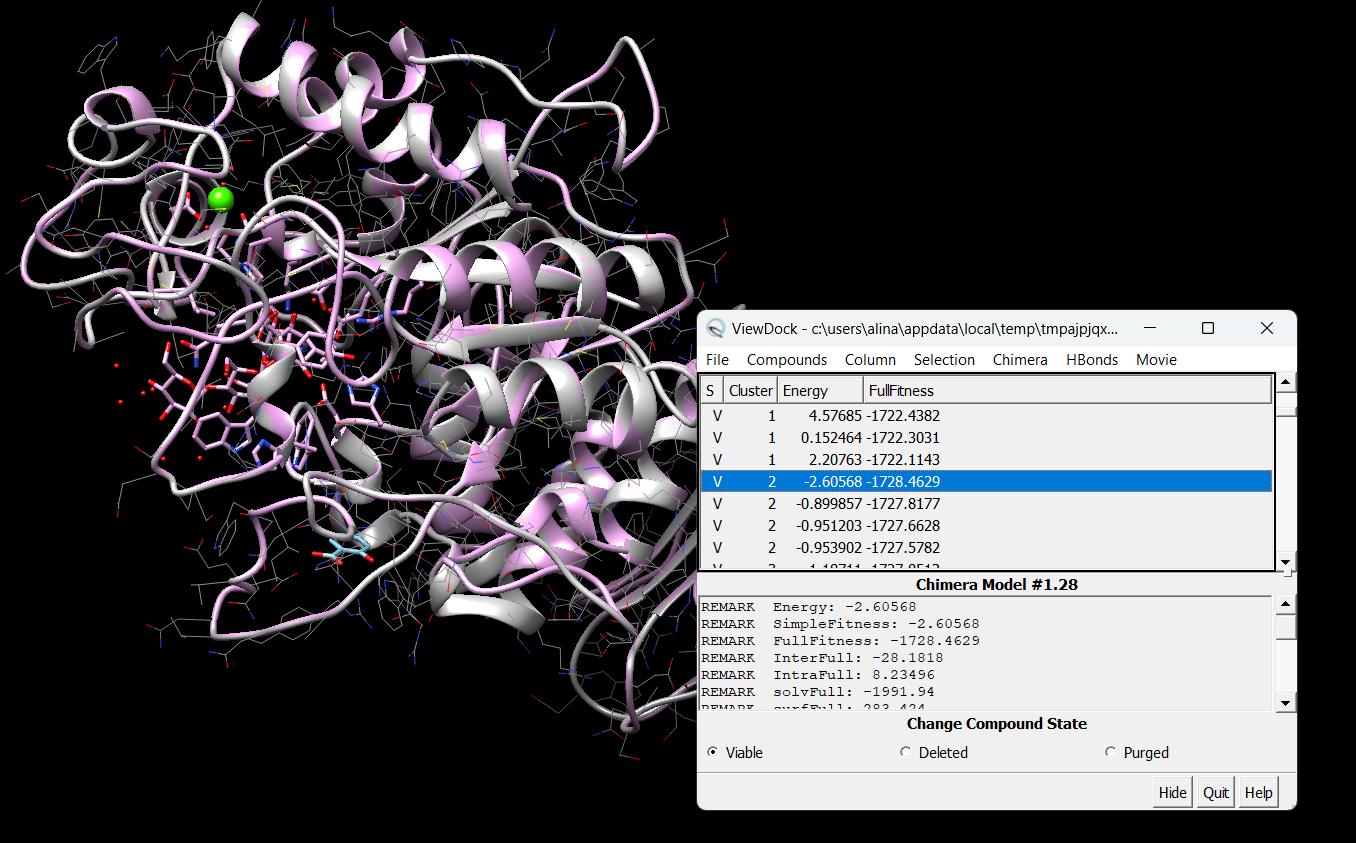
∆G = -10.9 кДж/моль
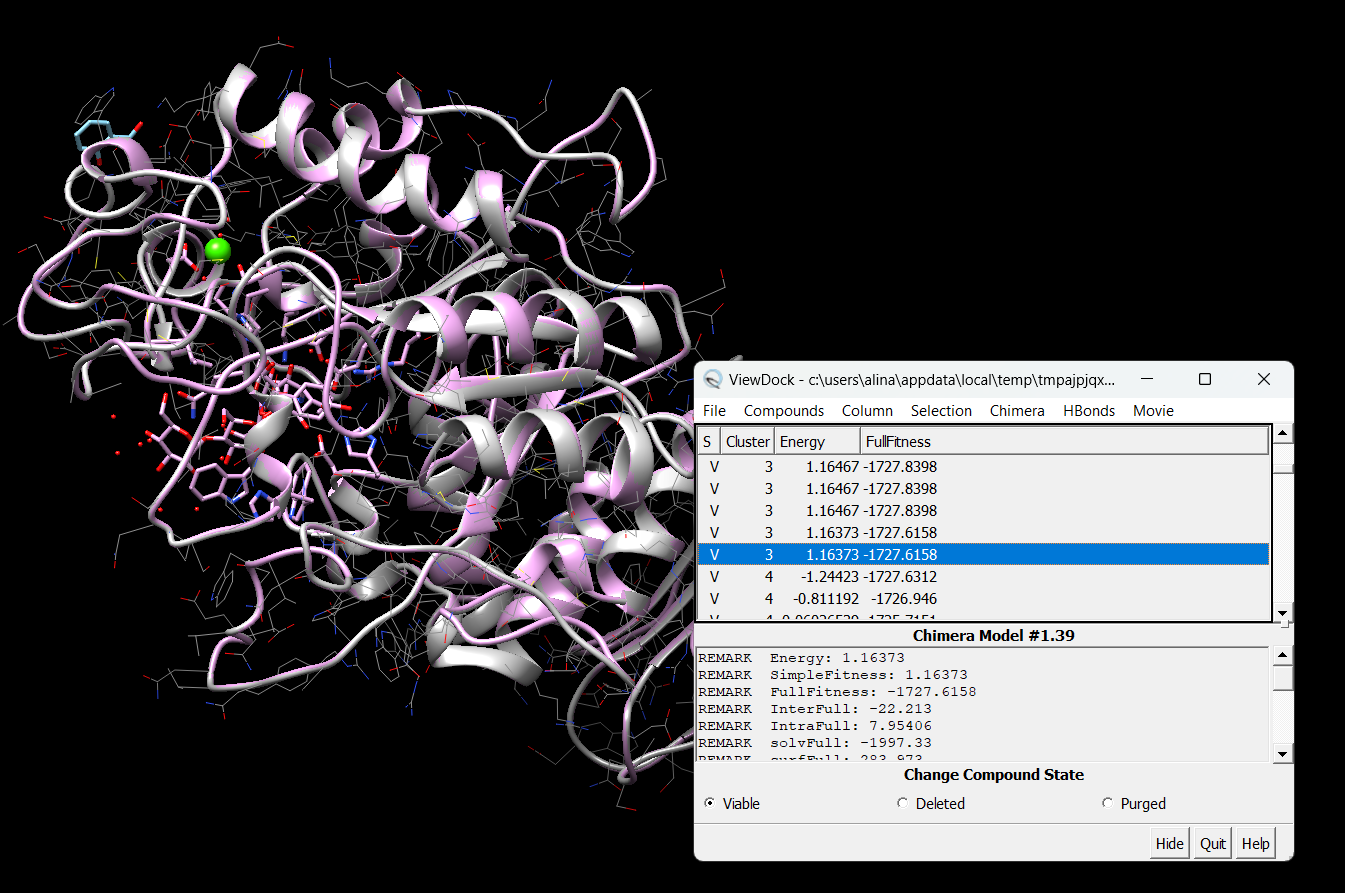
∆G = 4.887 кДж/моль
∆G = -5.2 кДж/моль

∆G = - 3.6кДж/моль
Вывод: Входе лабораторной работы проведён докинг амилазы с салициловой кислотой, наблюдалось совпадение при сравнении полученных данных со стркутурой содержащей акарбозу
Цели:Провести проверку работы докинга интернет-ресурса SwissDock, с помощью известной структуры амилазы.
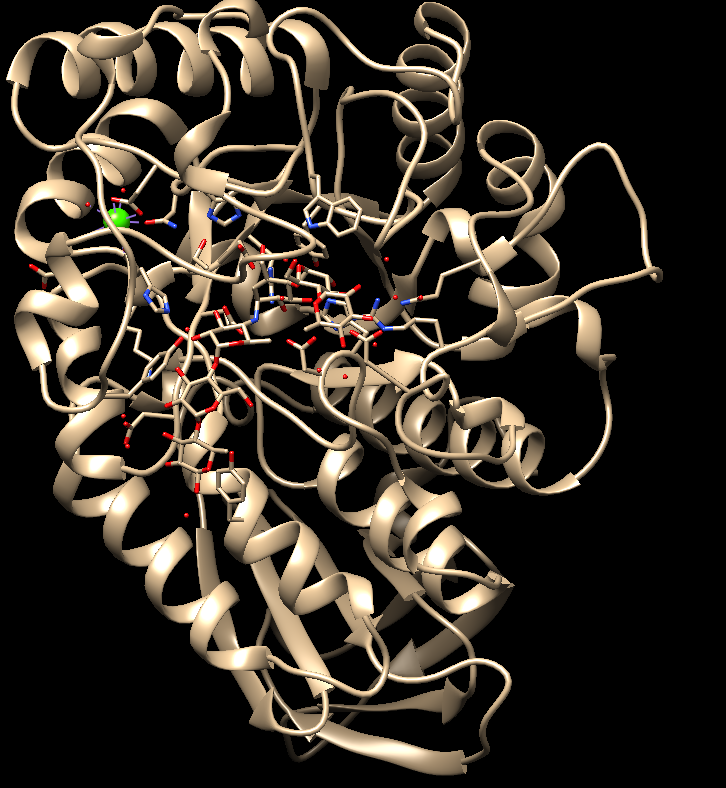
Рисунок – 1. Структура белка 7ТАА
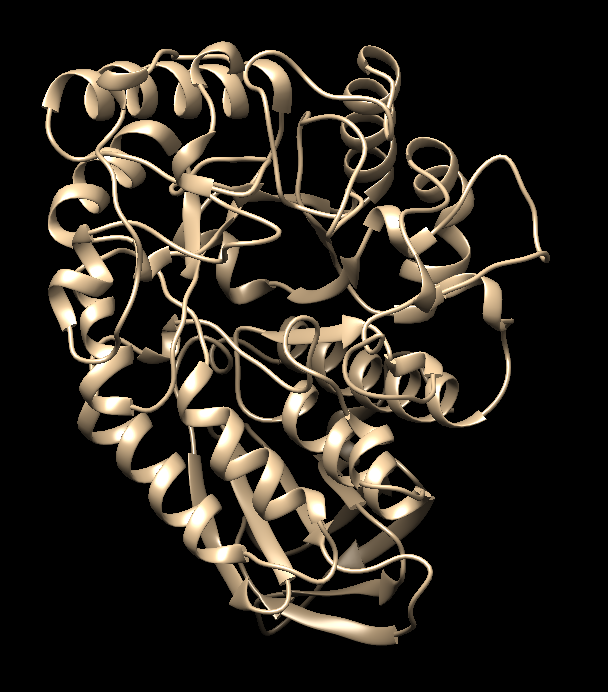
Рисунок - 2. Очищенный от лиганда белок 7ТАА
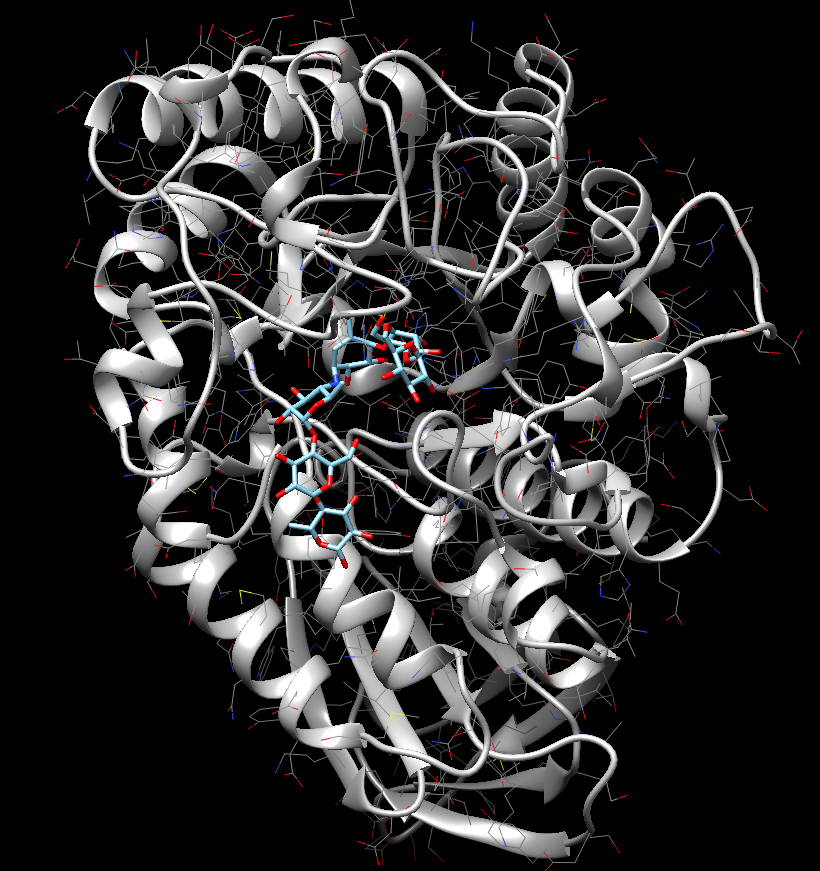
Рисунок – 3 полученная структура 7ТАА
Вывод: Входе лабораторной работы проведена проверка работы докинга интернет-ресурса SwissDock, с помощью известной структуры амилазы. Лиганд белка 7ТАА оказался в изначальном положении
Цель работы: экспериментально определить влияние салициловой кислоты на амилазу
Ход работы:
Провести приготовление 1 мл 10мМ раствора салициловой кислоты в ДМСО
Провести подбор необходимого объема амилазы и времени работы фермента, за который амилаза разрушает крахмал. Для этого в пенициллиновые флаконы разлили по 200 мкл 0,5% крахмала, 800 мкл воды и 800 мкл амилазы, содержащейся в слюне. После добавления всех компонентов спустя некоторые промежутки времени (30 секунд, 1 минута и т.д.) в флаконы добавляли 20 мкл йода. В случае, если амилаза не успела разрушить крахмал, наблюдалось посинение раствора, в ходе реакции молекулы йода внедрялись в молекулу крахмала. После того как амилаза разрушила крахмал до олигосахаридов при добавлении йода посинение раствора не наблюдалось. Оптимальным временем реакции оказалась 2 минута – раствор имел слегка голубоватую окраску.
После подбора объема и времени реакции в первый пенициллиновый флакон добавляем по 200 мкл 0,5% крахмала, 800 мкл воды и 20 мкл йода. Раствор сразу же приобретает синюю окраску – с помощью данного раствора проводим подбор оптимальной длины волны для УФ-спектроскопии.
Во второй флакон добавляем 200 мкл 0,5% крахмала, 800 мкл воды, в третий флакон 200 мкл 0,5% крахмала, 800 мкл воды и 10 мкл раствора салициловой кислоты. После в каждый флакон добавляем 800 мкл амилазы и засекаем 2 минуты. По истечению времени капаем 20 мкл йода в оба флакона. В случае, если исследуемое вещество окажется ингибитором раствор с веществом будет визуально более синим.
Концентрация салициловой кислоты в третьем флаконе:
Vк=200+800+10+800=1810мкл
С=10/1810=55мкМ

Рисунок 1 –Полученный результат
По окраске можно предположить о том, что вещество не является ингибитором.
В каждый флакон добавляем по 5 мл воды. С помощью проводим подбор оптимальной длины волны для УФ-спектроскопии. Длина волны составила 620 нм. Снимаем УФ-спектр для двух оставшихся пенициллиновых флаконов. Были получены следующие значения:
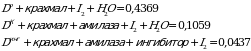
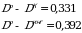
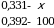
Х = 84,44
Вывод: Входе лабораторной работы экспериментально определили влияние салициловой кислоты на амилазу, подтвердив, что вещество не является ингибитором. Полученный результат соответствует результату докинга.
Цель работы: оценить влияние соединения на процесс дыхания пекарских дрожжей с помощью измерения оптической плотности
Теоретическая часть
Дрожжи (Saccharomyces cerevisiae) обладают дыхательной цепью, подобной дыхательной цепи млекопитающих и других эукариот. Комплекс I (НАДН-убихинон-оксидоредуктаза) млекопитающих участвует в образовании протонного потенциала и обеспечивает синтез АТФ. У дрожжей существуют две НАДН-убихинон-оксидоредуктазы. Внутренняя Ndi -на внутренней мембране митохондрий и на внешней NDe. Однако они не создают протонный градиент, а лишь восстанавливают пул убихинона. Далее пути электронного транспорта схожи. На комплексе III восстановленный убихинол восстанавливает цитохром С (генерация протонного потенциала), который на комплексе IV (цитохромоксидаза) «отдает» электроны на кислород с последующим образованием воды.

Таким образом, дыхательная цепь дрожжей может использоваться как модель для поиска биологически активных соединений, препятствующих производству энергии в организме (снижение синтеза АТФ).
Процесс дыхания дрожжей можно отслеживать непосредственно по скорости поглощения кислорода. Но для этого требуется кислородный электрод (электрод Кларка) и полярограф. Также к недостаткам прямого определения скорости дыхания можно отнести относительно большие объемы камеры и невозможность одновременного определения больше одного соединения. Что затрудняет проверку большого числа соединений за небольшой промежуток времени.
Другой вариант определения передачи электронов по дыхательной цепи заключается в использовании соединений, восстанавливающихся вдоль электронотранспортной цепи. К таким соединениям относят соли тетразолия, бесцветные в окисленном и окрашенные в восстановленом состоянии (формазаны). Существуют более двух десятков солей тетразолия (нитросиний тетразолий, иоднитротетразолий и др). Считается, что восстановление солей тетразолия в основном идет флавинсодержащих белках (комплексы I, II,) и возможно на комплексе III. Чем интенсивнее дыхание, тем быстрее электронный ток и соответственно увеличивается скорость образования окрашенного формазана.
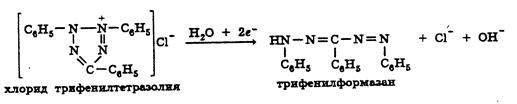
Однако при использовании наиболее распространенный тетразолиевых солей (МТТ, НСТ) ингибирование комплексов III или IV приведет к парадоксальному ускорению образования формазана, при этом поглощение кислорода не будет фиксироваться (ингибиторы цитохромоксидазы цианид или азид). Увеличение скорости образования формазана происходит из-за «перевосстановления» флавинмононуклеотида (ФМН) или флавинадениндинуклеотида (ФАД), входящих в состав комплексов I и II.
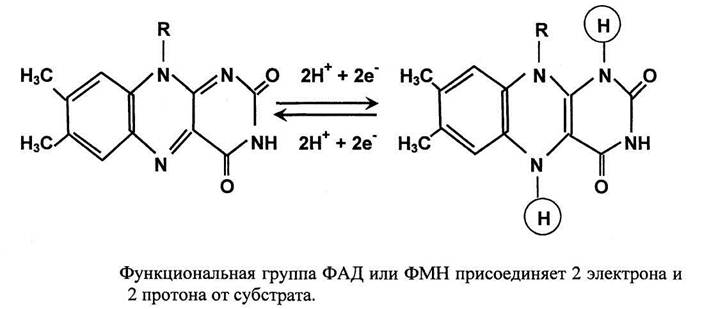
Для солей трифенилтетразолия (ТФТ) было замечено, что при наличии кислорода в системе восстановление не происходит из-за реокисления образующегося формазана. Таким образом, если не происходит дыхание (т.е. поглощение кислорода), то и ТФТ не восстанавливается. Данное обстоятельство позволяет использовать именно ТФТ для оценки влияния соединений на процесс поглощения кислорода и связанный с этим транспорт электронов по дыхательной цепи.
