
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение высшего образования
«НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»

Инженерная школа новых производственных технологий
12.03.02 «Оптотехника»
Лабораторная работа №2
Влияние кристаллизации на структуру и свойства металлов и сплавов
по дисциплине:
Материаловедение в приборостроении
Исполнитель: |
|
|
20.12.22 |
|
|
|
|
студент группы |
4В11 |
|
|
|
|
|
|
Руководитель: |
|
|
|
|
|
|
|
преподаватель |
|
Чинков Е.П. |
|
Томск - 2022
Цель работы
Изучить механизм и кинетику процесса кристаллизации.
Изучить макроструктуру металлических слитков.
Изучить влияние условий кристаллизации на структуру и механические свойства металла.
Материалы и оборудование для выполнения работы
Водные растворы солей (хромпика К2Сr2О7, перманганата калия КМnО4, поваренной соли NaCl), биологические микроскопы, металлические слитки, сплав алюминия с кремнием (силумин), муфельная электропечь с термопарой и автоматическим потенциометром, металлическая форма (кокиль), керамическая форма, маятниковый копер МК-30.
Теоретическая часть
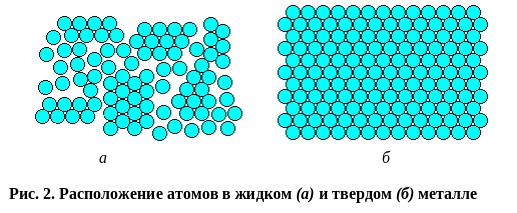
Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое, кристаллическое. В расплавленном металле нет дальнего порядка: расстояния между атомами не являются постоянными, объемы с упорядоченным расположением атомов то возникают, то снова исчезают (рис. 2,а). В процессе кристаллизации устанавливается дальний порядок: атомы располагаются на определенных расстояниях по каждому пространственному направлению, образуя кристаллическую решетку (рис. 2,б). Такое упорядоченное расположение возникает за счет равновесия сил притяжения и отталкивания между атомами и соответствует минимуму энергии взаимодействия атомов в металле.

Процесс кристаллизации может идти самопроизвольно, а может вызываться какими-то искусственными причинами.
Самопроизвольно идут только те термодинамические процессы, которые приводят к уменьшению свободной энергии системы.
Переход металла из жидкого или парообразного состояния в твердое (кристаллическое) называется первичной кристаллизацией. Образование новых кристаллов в твердом теле называют вторичной кристаллизацией. Процесс кристаллизации, как установил Д. К. Чернов, осуществляется в два этапа: возникновение зародыша и рост из него кристалла. Различают гомогенное (в объеме жидкой фазы) и гетерогенное (на поверхности твердых частиц, неметаллических включений, стенок изложниц и др.) зарождение кристаллов.
Гомогенная кристаллизация
Состояние системы характеризуется внутренней энергией, которая складывается из энергии движения атомов (ионов), электронов, энергии упругих искажений кристаллической решетки и т. д. Часть энергии, которая при изотермических условиях может быть превращена в работу, называется свободной:

 (1)
(1)
где F – свободная энергия, U – полная внутренняя энергия, T – температура; S – энтропия. Вещество может находиться в твердом, жидком или газообразном агрегатных состояниях. Переход в новое состояние возможен, если оно обладает меньшим запасом свободной энергии.
С ростом температуры свободная энергия F металла в жидком и твердом состояниях уменьшается (рис. 3):

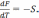 (2)
(2)
При равновесной температуре кристаллизации Тs свободные энергии жидкой и твердой фаз одинаковы, обе фазы сосуществуют одновременно, изменения энергии не происходит:
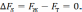 (3)
(3)
Процесс кристаллизации должен быть термодинамически выгоден, и сопровождаться уменьшением свободной энергии системы. Это возможно тогда, когда жидкая фаза будет охлаждена ниже Тs до практической температуры кристаллизации Ткр. Переход из жидкого состояния в твердое сопровождается выделением энергии:
 (4)
(4)
Охлаждение расплава ниже равновесной температуры называют переохлаждением и характеризуют степенью переохлаждения:
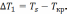 (5)
(5)
Плавление – процесс обратный кристаллизации – происходит при перегреве выше равновесной температуры. Переход из твердого состояния в жидкое сопровождается поглощением энергии:
 (6)
(6)
Нагревание расплава выше равновесной температуры называют перегревом и характеризуют степенью перегрева:
 (7)
(7)
Разница между реальными температурами плавления и кристаллизации – температурный гистерезис.
Механизм процесса кристаллизации
При переходе жидкого металла в твердое состояние выигрыш в свободной энергии (рис. 4, кривая 1) должен быть больше затрат энергии на образование поверхности раздела жидкость–кристалл (кривая 2). Изменение свободной энергии системы ∆F определяется алгебраической суммой поверхностной S*σ и объемной V*∆f энергий зародыша:
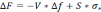 (8)
(8)

где S – поверхность зародыша; σ – удельное поверхностное натяжение на границе раздела; V – объем зародыша; ∆f – разность свободных энергий жидкого и кристаллического состояний, приходящаяся на единицу объема. Увеличение размера зародыша сначала приводит к росту свободной энергии (объем зародыша мал, поверхность велика), при некотором критическом значении r0 – к уменьшению (кривая 3). Зародыши образуются независимо друг от друга, растущие кристаллы имеют правильную форму (рис. 5).

При срастании с другими кристаллами форма нарушается, кристаллы называют зернами. Их рост продолжается в направлениях оставшихся участков жидкого металла.
При медленном охлаждении степень переохлаждения ∆T1 мала (рис. 6), кристаллизация протекает при высокой температуре, близкой к равновесной. В расплаве за единицу времени в единице объема образуется мало зародышей (размерность – мм-3∙с-1) из которых вырастают крупные кристаллы. Новые зародыши, как правило, не образуются. При очень маленькой скорости охлаждения возникает один центр кристаллизации, из которого вырастет один кристалл (монокристалл). Необходимые в электронике монокристаллы полупроводников выращивают путем очень медленного вытягивания затравки из расплава.

Рис. 6. Зависимость числа центров и скорости кристаллизации от степени переохлаждения
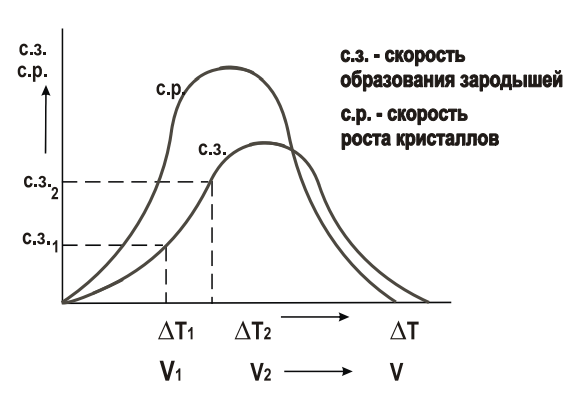

С увеличением степени переохлаждения ∆T2 (рис. 6) кристаллизация протекает при более низкой температуре. Число зародышей увеличивается, из них вырастает много мелких кристаллов.
При максимальной скорости охлаждения диффузия атомов мала, число центров кристаллизации и скорость роста кристаллов равны нулю, образуется аморфная структура – металлическое стекло.
Тепловое движение атомов в металле замедляется, атомы не успевают образовать дальний порядок, выстроиться в кристаллическую решетку. Жидкое, неупорядоченное состояние металла оказывается как бы «замороженным». Металл становится твердым, но не имеет кристаллического строения. Это аморфный металл или металлическое стекло. Аморфные металлы широко применяются в современной аудиотехнике благодаря уникальным магнитным свойствам.
Гетерогенная кристаллизация
Самопроизвольное образование зародышей происходит только в чистом жидком металле. Образование зародышей часто происходит на инородных включениях (примесях), которые всегда присутствуют в расплаве.
Если атомы примеси и затвердевающего металла имеют одинаковые кристаллические решетки (структурный фактор) и размеры атомов не отличаются более чем на 5–7 % (размерный фактор), то такие изоморфные примеси играют роль готовых центров кристаллизации. Структурное сходство между поверхностями сопряжения зародыша и включения приводит к уменьшению критического размера зародыша. Затвердевание начинается при меньшем переохлаждении, чем при самопроизвольной кристаллизации. Чем больше примесей, тем больше центров кристаллизации и мельче зерно. Такое образование зародышей называют гетерогенным. Кристаллизация обычно начинается от стенок формы, которые играют ту же роль, что и включения.
Если неизоморфные примеси имеют контакт с затвердевающим металлом, то строение их поверхностного слоя изменяется, приспосабливаясь к строению кристаллов металла – активация примесей. На активированной примеси осаждаются атомы затвердевающего металла.
Растворенные в жидком металле поверхностно-активные примеси могут измельчать зерно и изменять форму растущего кристалла, осаждаясь тонким слоем на его поверхности. Это приводит к уменьшению поверхностной энергии на границе раздела.
модифицирование – введение в расплав различных веществ (модификаторов) с целью повышения механических, технологических и эксплуатационных свойств отливок посредством измельчения структуры. Кроме модифицирования, применяют физические воздействия на структуру кристаллизующегося металла: регулирование температуры расплава и его охлаждение при переливе, вибрацию, ультразвук, электромагнитное перемешивание и др.
Комбинированные способы: ввод модификаторов и наложение колебаний с ультразвуковой частотой.
Установлено два типа воздействия модификаторов на структуру.
Монотонное измельчение зерна с повышением содержания модификатора. При содержании более 0,2–0,6 % оно стабилизируется.
Немонотонное измельчение зерна с областью оптимальной концентрации 0,01–0,1 %. Превышение приводит к увеличению размера зерна.
Монотонное уменьшение размера зерна с повышением концентрации модификатора характерно для нерастворимых примесей (титан в алюминии), немонотонное – для поверхностно-активных растворимых примесей (например, магний в цинке).
При модифицировании алюминиевых сплавов применяют Ti, V, Zr; стали – Al, V, Ti. Бор используют в качестве поверхностно-активного модификатора для никелевых и железных сплавов, магний – для чугуна.
Демодификаторы – добавки, повышающие размер зерна. Они увеличивают работу образования зародыша, задерживают его образование и понижают вероятность возникновения центра кристаллизации.
К ним относятся: свинец, олово, теллур, титан, алюминий, медь – для чугуна.
Строение металлического слитка

Жидкая сталь перед разливкой имеет температуру около 1600 °С. Кристаллизация начинается у холодных стенок и дна формы – изложницы (рис. 8,а) и распространяется внутрь. В условиях сильного переохлаждения образуется корковая зона 1 из мелких кристаллов.
По мере охлаждения жидкого металла между стенкой изложницы и застывшим металлом образуется воздушная прослойка. Скорость охлаждения жидкого металла у нагретой стенки снижается. Рост кристаллов происходит в направлении, обратном теплоотводу – перпендикулярно стенкам изложницы. Максимальная скорость роста наблюдается по направлениям и плоскостям, которые имеют наибольшую плотность упаковки атомов. Вырастают длинные ветви – оси I порядка, на них формируются поперечные оси II порядка, от которых ответвляются оси III порядка и т. д. Кристалл разветвляется, его ветви становится длиннее и толще. Постепенно его ветви занимают все промежутки между осями дендрита. Формируются древовидные кристаллы (рис. 8,б) – дендриты (от греч. dendron – дерево), образующие зону 2 столбчатых кристаллов. В центре дендрита больше тугоплавких компонентов, на периферии – легкоплавких. Химическая неоднородность, которая наблюдается в объеме отдельных кристаллов, дендритов, называется внутрикристаллической (дендритной) ликвацией, в объеме всего слитка – зональной ликвацией.
Теплоотвод от жидкого металла в центре слитка происходит равномерно, степень переохлаждения минимальна, образуются крупные кристаллы с произвольной ориентацией.
В верхней части слитка металл застывает в последнюю очередь. При охлаждении сплав уменьшается в объеме и образуется усадочная раковина. Жидкий металл стекает вниз и заполняет пустоты между кристаллами. Под затвердевшей коркой сплав имеет рыхлую структуру (пористость). Верхняя часть слитка (15–20 % от длины) отрезается и переплавляется.
Следует иметь в виду, что при получении отливок затвердевание металла в форме происходит с разными скоростями охлаждения в различных ее частях. Скорость охлаждения уменьшается от стенки формы к центральной ее части, при этом меняется и направление теплоотвода в местах роста кристаллов. В результате полученный слиток имеет неодинаковое строение по сечению, а значит, и разные свойства (рис. 8). Поверхностный слой будет мелкозернистый (т. е., с высокими механическими свойствами), а центральная часть слитка ‑ крупнозернистая.
Размер этих зон существенно меняется в зависимости от состава металла и условий кристаллизации.
Порядок выполнения работы
1. Ознакомится с теоретическими сведениями по теме работы.
2. С помощью биологического микроскопа проследить ход кристаллизации различных солей из пересыщенных водных растворов. Зарисовать начальную, промежуточную и конечную стадии кристаллизации, изобразить характерную форму кристаллов каждой соли. При этом обратить внимание, в каких местах капли раствора процесс кристаллизации начинается раньше и протекает интенсивнее. Описать и объяснить результаты наблюдений.
3. Изучить и зарисовать макроструктуру слитка металла. Указать на рисунке зоны кристаллизации, объяснить их образование.
4. Расплавить алюминиевый сплав (силумин) и залить в металлическую и керамическую формы. После затвердевания и охлаждения слитков провести испытания на ударную вязкость на маятниковом копре, зарисовать макроструктуру изломов. Объяснить различие в строении и свойствах слитков, полученных в металлической и керамической формах.
