
Лаба3
.docxСанкт-Петербургский Политехнический университет Петра Великого
ОТЧЕТ
по лабораторной работе №3
«Химическое равновесие»
Студентка группы 3331505/10001 Гричачина А.А.
Преподаватель Крылов Н.И.
Санкт-Петербург
28.10.2021 г.
Влияние концентрации на химическое равновесие
Опыт 1
Взаимодействие хлорида железа(III) и тиоцианата калия
Ход работы
Изучим химическое равновесие реакции между растворами хлорида железа(III) и тиоцианата калия(KCNS). Для этого в четыре пробирки внесем по 5–6 капель очень разбавленных (Cэк=0,0025 моль/л) растворов хлорида железа(III) и тиоцианата калия. Растворы перемешаем стеклянной палочкой и поставим на штатив. Одну пробирку с полученным раствором сохраним в качестве эталона. В каждой из остальных пробирок увеличим равновесную концентрацию одного из веществ путем добавления: в первую – одной капли насыщенного раствора хлорида железа(III), во вторую – одной капли насыщенного раствора тиоцианата калия, в третью – нескольких кристалликов хлорида калия. Сравним интенсивность окраски полученных растворов с интенсивностью окраски эталона.
Реакция:
Ионное уравнение:
Краткое ионное:
Константа равновесия:
Изменения, происходящие в равновесной системе |
|
|
|
Интенсивность окраски раствора |
Раствор темнее эталона (красный цвет) |
Раствор темнее эталона и пробирки с добавлением FeCl3 (кроваво-красный цвет) |
Раствор светлее эталона (жёлтый цвет) |
Смещение химического равновесия |
В сторону прямой реакции (вправо) |
В сторону прямой реакции (вправо) |
В сторону обратной реакции (влево) |
При повышении концентрации хлорида железа (III) (Сконц(FeCl3)↑) раствор темнеет. Равновесие смещается в сторону прямой реакции (вправо).
При повышении концентрации тиоцината калия (Сконц(KCNS)↑) раствор темнеет. Равновесие смещается в сторону прямой реакции (вправо).
При повышении концентрации хлорида калия (Ствёрд(KCl) ↑) раствор светлеет. Равновесие смещается в сторону обратной реакции (влево).
Опыт 2
Взаимодействие хлорида магния с гидроксидом аммония
Изучим химическое равновесие реакции между растворами хлорида магния и гидроксида аммония с образованием малорастворимого гидроксида магния. В пробирку внесем 3-4 капли раствора хлорида магния и постепенно (по каплям) добавим раствор гидроксида аммония до образования большого количества осадка гидроксида магния. К полученному осадку добавим по каплям концентрированный раствор хлорида аммония до уменьшения количества осадка. Затем в ту же пробирку прибавим концентрированный раствор гидроксида аммония до увеличения количества осадка.
Реакция:
Константа равновесия:
Вывод по результатам реакций:
При увеличении концентрации хлорида аммония (Сконц(NH4Cl)↑) осадок растворяется. Равновесие смещается в сторону обратной реакции (влево).
При увеличении концентрации гидроксида аммония (Сконц(NH4OH)↑) осадок появляется. Равновесие смещается в сторону прямой реакции (вправо).
Влияние температуры на химическое равновесие
Опыт 3
Димеризация диоксида азота
Изучим химическое равновесие между диоксидом азота и тетраоксидом диазота (N2O4). Предварительно получим диоксид азота. Для этого в две пробирки нальем по 1 мл концентрированной азотной кислоты и опустим в каждую из них по кусочку меди. Затем закроем обе пробирки пробками с газоотводными трубками, соединенными между собой резиновым шлангом. Наблюдаем бурное выделение газа. После полного растворения меди в системе устанавливается равновесие между диоксидом азота (бурый газ) и тетраоксидом диазота (бесцветный газ), Смесь этих газов окрасилась в желтый.
Реакция получения:
Реакция:
ΔH<0
Две пробирки заполненные газовой смесью (NO2, N2O4) опустим в стаканы с холодной и горячей водой. Через некоторое время мы наблюдаем в стакане с горячей водой усиление интенсивности бурой окраски, а в стакане с холодной водой – ослабление.
Константа
равновесия:
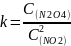
Вывод: При погружении пробирки в горячую воду равновесие сместилось в сторону обратной реакции (влево), цвет газа поменялся на бурый. При погружении пробирки в холодную воду равновесие сместилось в сторону прямой реакции (вправо), газ стал бесцветным.
При повышении температуры равновесие смещается в сторону обратной реакции, т.к. при повышении температуры равновесие всегда смещается в сторону эндотермической реакции. Следовательно прямая реакция т.е. реакция димеризации – экзотермическая.
Тепловой эффект Q>0 (ΔH<0).
Общий вывод: В данной работе было изучено влияние концентрации и температуры на химическое равновесие гомогенных и гетерогенных реакций. Смещение химического равновесия обратимых реакций регламентируется принципом Ле Шателье: внешнее воздействие на равновесную систему, выраженное через изменение одного из ее параметров (концентрация, давление, температура), приводит к смещению равновесия в сторону процесса, вызывающего противодействие этому изменению.
