
Гинекология ответы на экзамен
.pdf
52. Рак шейки матки. Методы лечения в зависимости от стадии заболевания и возраста больных. Прогноз, профилактика.
Лечение
Лечение проводят в условиях стационара.
Лечение при каждой стадии рака шейки матки в значительной степени определяется размером первичной опухоли, степенью распространения заболевания и соматическим статусом пациентки. У молодых женщин оперативное лечение предпочтительнее, так как в этом случае в большей степени сохраняется функциональная активность яичников, предотвращаются атрофия и стеноз влагалища. Возможным объемом хирургического лечения при РШМ IA1 стадии у больных репродуктивного возраста является хирургическая/радиоволновая конизация шейки матки с последующим выскабливанием цервикального канала и, по показаниям, полости матки.
Важным критерием у пациенток IAI стадии РШМ является отсутствие
в краях резецированных тканей шейки матки или в соскобе из оставшейся части цервикального канала клеток рака! В случае их обнаружения показана реконизация. Это позволяет уточнить степень поражения шейки матки и определить дальнейшую тактику лечения. Если реконизация невозможна, пациентку лечат как при IB1 стадии РШМ, т.е. проводят расширенную тотальную гистерэктомию по Вертгейму (расширенная экстирпация матки).
Убольных перименопаузального возраста в отсутствие необходимости сохранения органа показана тотальная гистерэктомия (экстирпация матки). На стадиях IA2 стандартом является расширенная гистерэктомия — экстирпация матки с придатками и лимфаденэктомия.
При противопоказаниях к хирургическому лечению проводят альтернативную лучевую терапию (ЛТ). При необходимости сохранить детородную функцию у больной, согласно рекомендациям FIGO и NCCN, возможно выполнение хирургической конизации шейки матки с удалением лимфатических узлов (экстраперитонеальная или лапароскопическая тазовая лимфаденэктомия либо расширенная трахелэктомия).
Убольных РШМ IB1 и IIА1 вариантами выбора являются хирургический метод лечения (расширенная гистерэктомия), лучевая терапия или комбинированный метод.
Выбор метода лечения зависит от наличия ресурсов, опыта врача, возраста пациентки и наличия сопутствующих заболеваний.
Единого мнения о тактике лечения больных IB2 и IIА2 стадий РШМ нет. Возможно несколько вариантов лечения: 1) расширенная экстирпация матки. При наличии метастазов в тазовых лимфатических узлах обязательно выполняют поясничную лимфодиссекцию (удаление жировой клетчатки, содержащей лимфоузлы); 2) химиолучевое лечение; 3) неоадъювантная химиотерапия (ХТ) на основе препаратов платины с последующей расширенной экстирпацией матки. Стандартом лечения IIB–IVA стадий является сочетание лучевой и химиотерапии.
NB! Адьювантная (дополнительная, вспомогательная, англ. — adjuvant) терапия (лучевая, химиотерапия). Неоадьювантная
— этап подготовки к другому, основному виду лечения (хирургическое, лучевое).
Лучевая терапия может быть внутриполостной, дистанционной или сочетанной. На ранних стадиях РШМ у функционально неоперабельных больных лучевая терапия может применяться как самостоятельный метод без хирургического вмешательства. У больных с инвазией опухоли менее 3 мм лучевая терапия ограничивается внутриполостной аппликацией, дистанционного облучения не требуется.
NB! Начиная с IIb стадии рака шейки матки стандартом становится не хирургическое лечение, а сочетанная (дистанционная и внутриполостная) лучевая терапия.
Однако в значительном числе случаев именно во время операции окончательно устанавливается степень распространенности опухолевого процесса,
что накладывает отпечаток на характер дальнейшего лечения. При IIb-IIIb стадиях РШМ распространенность процесса является существенным фактором прогноза течения заболевания и выбора тактики лечения.
Если во время операции выявляется поражение тазовых и/или парааортальных лимфатических узлов, после лимфаденэктомии проводят лучевое воздействие на пораженные группы лимфатических узлов.
Прогноз
Пятилетняя выживаемость при РШМ I стадии составляет 78–80%,
II стадии — 40–60%, III стадии — около 30% и IV стадии — менее 8%.
Средний показатель пятилетней выживаемости по всем стадиям составляет около 55%. Прогноз ухудшается при сочетании рака шейки матки и беременности.
NB! Прогноз при раке шейки матки определяется, прежде всего, стадией заболевания.
Профилактика
Первичная профилактика. Наиболее перспективный метод первичной профилактики РШМ — вакцинация против онкогенных штаммов ВПЧ (квадри- и бивалентная вакцины Гардасил♠ и Церварикс♠). В некоторых странах мира зарегистрирована девятивалентная вакцина Гардасил 9.
Первые результаты клинических испытаний этих вакцин свидетельствуют об их высокой эффективности. Полагают, что вакцинация девочек до начала половой жизни приведет к значительному снижению заболеваемости раком уже через 15–20 лет (FIGO, 2009). Некоторые страны ввели вакцинацию девочек-подростков анти- ВПЧ-вакциной в Национальный календарь прививок.
Вторичная профилактика. Для успешной профилактики РШМ и его запущенных форм необходимы регулярные и массовые осмотры женщин
старше 20 лет с обязательным цитологическим исследованием, целью которых является выявление и лечение фоновых и предраковых заболеваний шейки матки. Для обнаружения патологических процессов используют кольпоскопию, ПЦРдиагностику ВПЧ.
Нормативной базой для скрининга в настоящее время служит Приказ МЗ
РФ Об утверждении порядка проведения диспансеризации определенных групп взрослого населения , где предусмотрены осмотр, в том числе фельдшером или акушеркой, и взятие мазков (соскобов) с поверхности шейки матки и из цервикального канала на цитологическое исследование. Периодичность такого скрининга для женщин в возрасте от 21 года до 69 лет включительно — 1 раз в 3 года.
Методы, применяемые при скрининге:
•осмотр;
•традиционное цитологическое исследование или жидкостная цитология;
•определение вирусов высокого онкогенного риска, при необходимости
ВПЧ-типирование, оценка вирусной нагрузки (количественное определение ВПЧ высокого онкогенного риска — Digene-тест, у женщин старше 30 лет или по показаниям).
Третичная профилактика. В масштабах популяции важной мерой профилактики РШМ служат приверженность практике использования латексных презервативов, информационно-образовательная работа с населением, направленная на предупреждение промискуитета, беспорядочных и незащищенных половых контактов.
Ведение пациенток, излеченных от РШМ. Обследование женщин, излеченных от РШМ, проводят каждые 3 мес в течение первых двух лет, затем 1 раз в год пожизненно. Фертильным пациенткам с ранней стадией заболевания после органосохраняющих хирургических вмешательств обязательно
цитологическое исследование шейки матки через 6, 12 мес и затем ежегодно в течение 4 лет.

53. Предрак тела матки. Клиника, методы диагностики и лечения
Предрак эндометрия. С морфологических позиций к предраку эндометрия относят гиперплазию с атипией (атипическая гиперплазия) и аденоматозные полипы.
К морфологическим признакам атипии эндометрия относят :
•увеличение числа желез, близко расположенных друг к другу, иногда с пальцеобразными выростами в направлении стромы;
•железистый цилиндрический эпителий в 2-4 ряда с формированием папиллярных выростов в направлении маточных желез, при выраженной атипии наблюдается потеря полярности;
•гиперхромные ядра с равномерным или (при большой атипии) с неравномерным распределением хроматина и глыбками его по периферии; высокую митотическую активность с увеличением спектра патологических митозов;
•базофильную цитоплазму при меньшей степени атипии, оксифиль-ную - при выраженной;
•наличие отечной стромы, с фибробластами и лимфоцитами;
•неравномерное распределение кровеносных сосудов с явлениями стаза и тромбоза.
Клиническая симптоматика. Основные клинические проявления гиперпластических процессов эндометрия - маточные кровотечения, чаще ациклические в виде метроррагий, реже меноррагии. При больших полипах эндометрия могут наблюдаются схваткообразные боли внизу живота. Иногда полипы эндометрия остаются бессимптомными, особенно в постменопаузе.
Поскольку патогенетическую основу гиперпластических процессов эндометрия у больных репродуктивного возраста составляет ановуляция, одним из симптомов является бесплодие, чаще первичное.
Диагностика гиперпластических процессов эндометрия. Скрининговыми методами диагностики гиперпластических процессов эндометрия являются трансвагинальное УЗИ, при неоднозначной эхографической картине возможно выполнение ГСГ, реже исследование аспирата из полости матки. Методами углубленного обследования являются гистероскопия и раздельное диагностическое выскабливание слизистой оболочки матки. Окончательно верифицировать диагноз можно только после гистологического исследования эндометрия.
Трансвагинальное УЗ-сканирование является высокоинформативным,
неинвазивным, безопасным методом диагностики гиперпластических процессов
эндометрия. Диагностика гиперплазии эндометрия при УЗИ основывается на выявлении увеличенного в переднезаднем размере срединного маточного эха (М- эха) с неоднородной акустической плотностью. У менструирующих женщин толщину М-эха следует оценивать в соответствии с фазой менструального цикла. Лучше всего проводить исследование сразу после менструации, когда тонкое М- эхо соответствует полному отторжению функционального слоя эндометрия, а увеличение переднезаднего размера М-эха на всем протяжении либо локально должно расцениваться как патология. В большинстве наблюдений отличить железистую гиперплазию эндометрия от атипической при УЗИ не удается.
Если период постменопаузы не превышает 5 лет, толщина М-эха до 5 мм может считаться нормальной, при постменопаузе более 5 лет она не должна превышать 4 мм (при однородной структуре).
Ультразвуковая картина полипов эндометрия показывает овоидные, реже округлые включения в полости матки повышенной эхоплотности.
Цитологическое либо гистологическое исследование аспирата из полости матки может использоваться в качестве скрининга патологии эндометрия. Аспирационная биопсия эндометрия может использоваться как метод контроля эффективности гормональной терапии при гиперпластических процессах эндометрия. При раке эндометрия она позволяет поставить диагноз и избежать гистероскопии и диагностического выскабливания, которые не отвечают принципам абластики.
Гистероскопия. Информативность гистероскопии в диагностике гиперпластических процессов эндометрия составляет 63-97%. Гистероскопия необходима и перед выскабливанием слизистой оболочки матки - для уточнения характера патологии и его локализации, и после него - с целью контроля тщательности удаления ткани.
При гиперплазии эндометрия и отсутствии кровяных выделений эндометрий, как правило, утолщен в виде складок различной высоты, бледно-розового цвета, отечный, в нем просматривается большое количество протоков желез. При изменении скорости потока жидкости в полость матки отмечается волнообразное движение эндометрия. Если гистероскопию проводят у пациентки с длительными кровяными выделениями, в дне матки и в области устьев маточных труб чаще определяются бахромчатые обрывки эндометрия бледно-розового цвета (на остальном протяжении эндометрий тонкий, бледный.
Атипическая гиперплазия эндометрия не имеет характерных эндоскопических критериев, гистероскопическая картина напоминает обычную железистокистозную гиперплазию. При тяжелой форме атипической гиперплазии могут определяться железистые полиповидные разрастания тусклого желтоватого или сероватого цвета. Чаще они пестрые, желтовато-сероватые с белесым налетом. Как правило, окончательный диагноз устанавливают после гистологического исследования.
Аденоматозные полипы эндометрия чаще локализуются ближе к устьям маточных труб и, как правило, бывают небольшого размера (0,5x1; 0,5x1,5 см), выглядят более тусклыми, серыми, рыхлыми (рис. 15.13), но могут визуально не отличаться от железисто-кистозных полипов; в этом случае характер полипа при эндоскопическом исследовании определить не удается.
Полипы эндометрия изменяют форму при изменении скорости подачи жидкости или газа в полость матки - они сплющиваются, увеличиваются в диаметре, при уменьшении давления вытягиваются в длину и совершают колебательные движения.
Гистологическое исследование соскобов слизистой оболочки матки -
окончательный метод диагностики гиперпластических процессов эндометрия.
Лечение гиперпластических процессов эндометрия. Терапия у женщин разного возраста складывается из остановки кровотечения, восстановления менструальной функции в репродуктивном периоде или достижения атрофии и субатрофии эндометрия в более старшем возрасте, а также профилактики рецидива гиперпластического процесса.
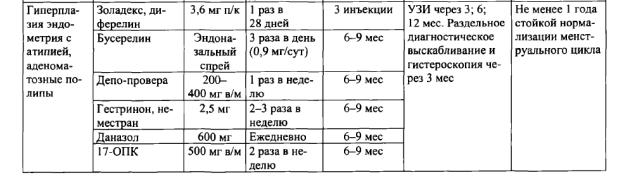
Ведение пациенток репродуктивного возраста с гиперпластическими процессами эндометрия. Традиционным методом лечения гиперпластических процессов эндометрия является гормональная терапия, которую назначают после гистероскопии, раздельного диагностического выскабливания и гистологического исследования. Схемы гормонального лечения представлены в таблице.
При неэффективности гормонотерапии и рецидиве атипической гиперплазии эндометрия или аденоматозных полипов целесообразно оперативное лечение, объем которого определяется индивидуально, возможно выполнение гистерэктомии, клиновидной резекции яичников (у больных с СПКЯ), аднексэктомии (при наличии гормонпродуцирующей опухоли яичника).
Лечение гиперпластических процессов эндометрия у пациенток в перимено-
паузе. Первый этап лечения включает гистероскопию с раздельным диагностическим выскабливанием слизистой оболочки матки. Выбор дальнейшей терапии зависит от морфологической структуры эндометрия, сопутствующей гинекологической и экстрагенитальной патологии. Выбор гормонального препарата, схема и длительность лечения определяются также желанием женщины сохранить менструации.
Схемы гормональной терапии гиперпластических процессов эндометрия в пре- и перименопаузе представлены в табл.
Рецидив гиперпластических процессов эндометрия, а также сочетание этой патологии с миомой матки и (или) внутренним эндометриозом у больных в пре- и перименопаузе требуют расширения показаний к радикальному оперативному вмешательству (гистерэктомии).
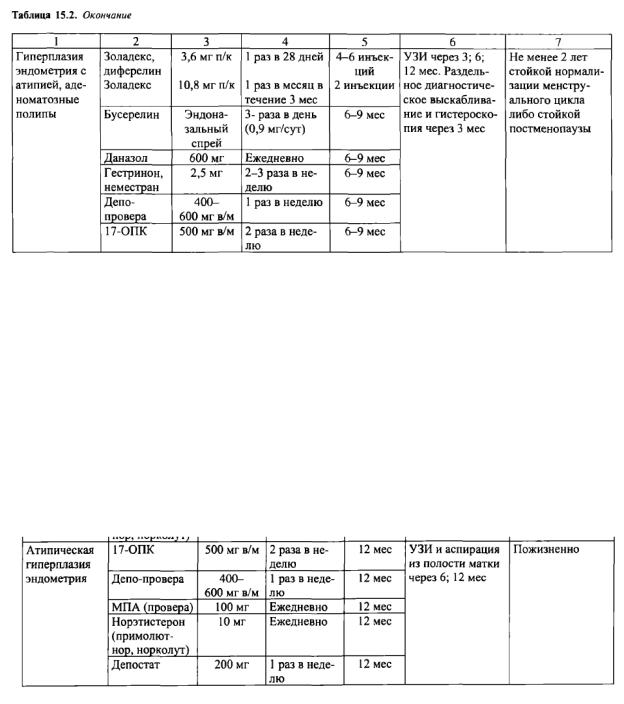
Ведение пациенток с гиперплазией эндометрия в постменопаузе.
При атипической гиперплазии эндометрия в постменопаузе необходимо сразу решать вопрос о радикальной операции - пангистерэктомии. При выраженной экстрагенитальной патологии и повышенном риске оперативного лечения (пангистерэктомии) необходимо длительное лечение гестагенами.
Схемы гормональной терапии гиперплазии эндометрия у пациенток периода постменопаузы представлены в табл.
С целью снижения риска осложнений гормонотерапии, назначаемой в любом возрасте по поводу гиперпластических процессов эндометрия, параллельно рекомендуют гепатопротекторы, антикоагулянты, антиагреганты.

54. Рак тела матки. Этиопатогенез, классификация, клиника, методы диагностики
Эпидемиология
РЭ — заболевание преимущественно женщин, находящихся в постменопаузе, однако в последние годы сформировалась тенденция к увеличению доли больных репродуктивного возраста.
Основное объяснение — аналогичное увеличение частоты ожирения — главного фактора риска РЭ, особенно в сочетании с гипертонической болезнью и диабетом.
Классификация
На основании данных гистологического исследования, клинического течения и эпидемиологии выделяют два патогенетических типа РЭ:
Тип I: включает аденокарциномы высокой и умеренной степени дифференцировки, доля которых в общей структуре РЭ достигает 80%. Эти опухоли эстрогензависимы и обычно имеют благоприятный прогноз. Им могут предшествовать предраковые изменения в эндометрии (атипическая гиперплазия эндометрия).
Тип II: включает около 10–20% РЭ, представленного низкодифференцированной аденокарциномой или другими гистологическими вариантами. Эти опухоли обычно эстроген-независимы, низкодифференцированные и имеют неблагоприятный прогноз. Предопухолевые изменения эндометрия у таких пациенток выявляются редко.
Морфологическая классификация эпителиальных опухолей тела матки
(ВОЗ, 2014 г.).
• Эндометриальная карцинома:
––вариант с плоскоклеточной метаплазией; ––виллогландулярный вариант; ––секреторный вариант.
•Муцинозная аденокарцинома.
•Серозная эндометриальная интраэпителиальная карцинома.
•Серозная карцинома.
•Нейроэндокринные опухоли:
––высокодифференцированная опухоль: ––карциноидная опухоль; ––низкодифференцированная карцинома: ––мелкоклеточная нейроэндокринная карцинома; ––крупноклеточная нейроэндокринная карцинома.
•Светлоклеточная карцинома.
•Смешанная аденокарцинома.
•Переходноклеточный рак.
•Недифференцированный рак.
•Недифференцированная карцинома.
Выделяют три степени гистопатологической дифференцировки аденокарциномы эндометрия:
• G1—высокодифференцированная аденокарцинома: 95% опухоли представлено железистыми структурами и 5%-солидными.
•G2 — умереннодифференцированная аденокарцинома: не менее 50% железистых участков и 6–50% солидных.
•G3 — солидная, недифференцированная аденокарцинома: более 50% солидные участки, но есть и железистые.
Стадирование РЭ проводится на основании результатов патоморфологического исследования после операции. Для стадирования РЭ применяют две классификации: TNM (7-е изд., 2009) и FIGO (2010):
Т — первичная опухоль (tumor);
•Тх — недостаточно данных для оценки первичной опухоли;
•Т0 — первичная опухоль не определяется;
•Т1 (FIGO–I) — опухоль ограничена телом матки;
Т1а (FIGO–IА) — опухоль ограничена эндометрием или инвазия менее 1/2 толщины миометрия;
•Т1b (FIGO–IВ) — опухоль распространяется на 1/2 и более толщины миометрия;
•Т2 (FIGO–II) — опухоль распространяется на шейку матки с инвазией стромы, но не за пределы матки;
•T3a (FIGO–IIIA) — опухоль вовлекает серозную оболочку и/или яичник
(прямое распространение или метастазы);
•T3b (FIGO–IIIВ) — опухоль распространяется на влагалище (прямое или метастазы) или на параметрии;
•Т4 (FIGO–IVA) — опухоль распространяется на слизистую оболочку мочевого пузыря и/или толстой кишки (присутствие буллезного отека недостаточно для отнесения опухоли к стадии Т4).
N — поражение регионарных лимфатических узлов (nodules):
•Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов;
•N0 — нет метастазов в регионарных лимфатических узлах;
•N1 (FIGO–IIIС1) — метастазы в тазовые лимфатические узлы;
•N2 (FIGO–IIIС2) — метастазы в парааортальные лимфатические узлы с наличием или без метастазов в тазовых лимфатических узлах.
M — отдаленные метастазы (metastases):
•M0 — нет отдаленных метастазов;
•М1 (FIGO–IVB) — отдаленные метастазы (включая метастазы в паховые лимфатические узлы, внутриабдоминальное распространение, легкие, печень, кости, исключая метастазы в парааортальные лимфатические узлы, влагалище, тазовую брюшину, придатки).
Факторы риска и этиология
К факторам риска РЭ относят:
•ожирение и метаболический синдром (СД, гипертоническая болезнь),
заболевания печени и особенно сочетания этих диагнозов. Ожирение второй степени увеличивает риск развития рака тела матки в 3 раза, третьей
— в 10 раз. При сахарном диабете риск развития рака тела матки увеличивается в 3 раза;
•длительную гиперэстрогению (неадекватное использование гормональных препаратов с высоким содержанием эстрогенов, МГТ чистыми эстрогенами без защиты эндометрия);
•прием тамоксифена;
•отсутствие родов в течение жизни;
•менархе до 12 лет;
•менопаузу после 50 лет;
•СПКЯ (повышает популяционный риск в 3 раза);
•эстрогенсекретирующие опухоли яичников.
Риск РЭ существенно повышен при синдроме Линча (семейный раковый синдром).
Патогенез
Рак тела матки развивается, как правило, на фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу. Это обусловлено гиперэстрогенией, основной причиной которой является нарушение/отсутствие овуляции.
NB! Рак эндометрия относится к гормонально зависимым опухолям.
Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности РЭ позволили обосновать концепцию двух основных патогенетических вариантов заболевания .
Первый патогенетический вариант (тип I) наблюдается у 60–70% больных РЭ и характеризуется сочетанием эндокринных и метаболических расстройств, предшествующих развитию высокодифференцированного рака эндометрия.
При этом варианте клинические проявления гиперэстрогении и ановуляции (аномальные маточные кровотечения, бесплодие, поздняя менопауза) сочетаются с нарушениями жирового и углеводного обмена (ожирение, сахарный диабет). Опухоль возникает на фоне гиперпластических процессов эндометрия и
стромы яичников, часто сочетается с другими гормонально-зависимыми опухолями (РМЖ, феминизирующие опухоли яичников), СПКЯ (выявляются у 62% больных РЭ). Опухоль у таких больных обладает высокой степенью дифференцировки, чувствительна к прогестагенам. Заболевание протекает менее злокачественно и сравнительно редко сопровождается лимфогенным метастазированием. Для первого
патогенетического варианта РЭ характерно наличие синхронных и метахронных первично-множественных опухолей и благоприятный исход заболевания (излечение до 86%).
Второму патогенетическому варианту (тип II, или автономный) рака тела матки, выявляемому у 30–40% больных, эндокринно-метаболические расстройства и симптомы гиперэстрогении не свойственны. При этом варианте нарушение овуляции и стероидного гомеостаза выражено нечетко или совсем отсутствует. Опухоль возникает на фоне атрофии эндометрия, чаще в постменопаузе, но может наблюдаться и у женщин моложе 50 лет.
Характерно сочетание с фиброзом стромы яичников. Отсутствие гормональной зависимости влечет за собой нарастание признаков автономности и прогрессии. В этих случаях опухоль низкодифференцированная, склонна к инвазивному росту и лимфогенному метастазированию, малочувствительна к прогестагенам. Основным молекулярным нарушением бывают мутации в гене белка р53. Течение заболевания менее благоприятно, при этом наличие синхронных опухолей не характерно.
Выделяют третий патогенетический вариант — генетический, мутации
