
- •РАЗДЕЛ 1: ВЗАИМОДЕЙСТВИЕ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ С ВЕЩЕСТВОМ
- •Лабораторная работа 2.1. РАБОЧАЯ ХАРАКТЕРИСТИКА СЧЕТЧИКОВ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
- •Лабораторная работа 2.2. СПЕКТРОМЕТРИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
- •РАЗДЕЛ 3: МАТЕМАТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ
- •Лабораторная работа 3.1. ПРОВЕРКА ГИПОТЕЗЫ О ПОДЧИНЕНИИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЯ АКТИВНОСТИ РАСПРЕДЕЛЕНИЮ ПУАССОНА
- •Лабораторная работа 3.2. ПРОВЕРКА ГИПОТЕЗЫ О ПРИНАДЛЕЖНОСТИ ДВУХ ВЫБОРОК ОДНОЙ ГЕНЕРАЛЬНОЙ СОВОКУПНОСТИ. ПОСТРОЕНИЕ ДОВЕРИТЕЛЬНЫХ ИНТЕРВАЛОВ
- •Лабораторная работа 3.3. НАХОЖДЕНИЕ ОПТИМАЛЬНОГО ВРЕМЕНИ ИЗМЕРЕНИЯ РАДИОАКТИВНОГО ПРЕПАРАТА. ОЦЕНКА ПОГРЕШНОСТИ РЕЗУЛЬТАТОВ КОСВЕННЫХ ИЗМЕРЕНИЙ
- •Лабораторная работа 4.1. ДОЗИМЕТРИЧЕСКИЙ КОНТРОЛЬ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ
- •1. Порядок проведения радиационного обследования
- •Вопросы для самоконтроля:
- •Лабораторная работа 5.1. ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ АКТИВНОСТИ ПРОБ ПОЧВЫ
- •2. Порядок выполнения работы
- •Лабораторная работа 5.2. ОПРЕДЕЛЕНИЕ ЕСТЕСТВЕННЫХ И ИСКУССТВЕННЫХ РАДИОНУКЛИДОВ В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ МЕТОДОМ γ – СПЕКТРОМЕТРИИ
- •Лабораторная работа 6.1. ОПРЕДЕЛЕНИЕ СОСТОЯНИЯ РАДИОНУКЛИДОВ В РАСТВОРЕ МЕТОДОМ УЛЬТРАФИЛЬТРАЦИИ
- •Результаты измерений и расчета доли коллоидов
- •Лабораторная работа 6.2. ИССЛЕДОВАНИЕ СОСТОЯНИЯ ТОРИЯ-234 В ВОДНОМ РАСТВОРЕ СОРБЦИОННЫМ МЕТОДОМ
- •4. Обработка результатов измерений
- •Лабораторная работа 7.1. СОРБЦИОННЫЕ МЕТОДЫ КОНЦЕНТРИРОВАНИЯ РАДИОНУКЛИДОВ ИЗ ПРИРОДНЫХ ВОД И ТЕХНОЛОГИЧЕСКИХ РАСТВОРОВ
- •Лабораторная работа 7.2. ВЛИЯНИЕ КОНЦЕНТРАЦИИ ФОНОВОГО ЭЛЕКТРОЛИТА НА ПРОЦЕССЫ МЕЖФАЗНОГО РАСПРЕДЕЛЕНИЯ РАДИОНУКЛИДОВ
- •Результаты измерений
- •Результаты расчетов
- •5. Вопросы для самоконтроля
- •Лабораторная работа 7.3. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОГО РЕЖИМА СОРБЦИИ ЦЕЗИЯ НЕОРГАНИЧЕСКИМИ СОРБЕНТАМИ ИЗ ПРИРОДНЫХ ВОД
- •Лабораторная работа 7.4. РАЗДЕЛЕНИЕ РАДИОНУКЛИДОВ ТОРИЯ И УРАНА В ДИНАМИЧЕСКИХ УСЛОВИЯХ
- •Таблица 7.9
- •Динамика сорбции и десорбции тория (урана)
- •Механизм
- •Опыт 1
- •Лабораторная работа 8.1. ПРИМЕНЕНИЕ ИЗОТОПНЫХ ГЕНЕРАТОРОВ ДЛЯ ПОЛУЧЕНИЯ КОРОТКОЖИВУЩИХ РАДИОНУКЛИДОВ
- •Результаты измерений и расчетов
- •Лабораторная работа 8.2. ЭКСПРЕССНЫЙ РАДИОХИМИЧЕСКИЙ АНАЛИЗ ВОДНЫХ СРЕД С ПРИМЕНЕНИЕМ СОРБЦИОННОГО КОНЦЕНТРИРОВАНИЯ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •Учебное издание
- •Редакционно-издательский отдел ИПЦ УрФУ

Лабораторная работа 6.2. ИССЛЕДОВАНИЕ СОСТОЯНИЯ ТОРИЯ-234 В ВОДНОМ РАСТВОРЕ СОРБЦИОННЫМ МЕТОДОМ
1. Сорбционный метод исследования состояния микроколичеств веществ в водном растворе
Проблема состояния микрокомпонентов в водных растворах возникла в радиохимии уже в начале 20-ого века. К этому времени появились экспериментальные факты, свидетельствующие о том, что многие элементы конца периодической системы, такие как торий, висмут, таллий, свинец, химические свойства которых были достаточно хорошо известны, находясь в микроконцентрациях в водных растворах, часто ведут себя совершенно непредсказуемым образом. Было установлено, что решающую роль в этих аномалиях играют процессы сорбции и коллоидообразования. Ниже рассматривается сорбционный метод исследования состояния микроколичеств веществ в водном растворе.
Сорбат – микрокомпонент представлен единственной формой
В этом случае его сорбционное поведение описывается законом Генри:
|
= Kd CM или ε = Kd [m], |
(6.2) |
CM |
где CM – концентрация микрокомпонента в твердой фазе, СМ – концентрация микрокомпонента в растворе в условиях равновесия, Kd
– коэффициент распределения, [m] – удельная масса сорбента, ε - сорбционное отношение. Прологарифмировав, получаем выражение изотермы сорбции
lgε = lg Kd + lg[m]. |
(6.3) |
Очевидно, что для моносортового сорбата величина коэффициента распределения в области Генри не зависит от удельной массы сорбента, т.е. ∂lg Kd / ∂lg[m] = 0. Тогда можно сделать обратное заключение: если сорбат моносортовой, то изотерма сорбции в
координатах «lgε - lg[m]» представляет собой прямую с угловым коэффициентом, равным единице (рис.6.2).
Сорбат – микрокомпонент представлен несколькими формами, между которыми существует лабильная связь.
89
Систему ионно-молекулярных, полимерных и коллоидных форм состояния сорбата называют лабильной (лабильный сорбат), если скорость всех протекающих в ней реакций взаимного превращения одних форм в другие значительно выше скорости сорбции:
M z+ ↔ ML(z-1)+ ↔ ML(z-2)+ |
↔ MLz0 ↔ … MLn (z-n)-. |
|
В силу этого внесение в раствор сорбента не вызывает смещения |
||
динамического равновесия |
между |
ионно-диспесными и |
псевдоколлоидными формами состояния сорбата и доля каждой формы αi = const ≠ f[m]. Отсюда следует, что для лабильного сорбата, представленного в растворе любым набором ионодиспесных и псевдоколлоидных форм состояния, также как и для сорбата, представленного в растворе единственной формой состояния, должно
выполняться соотношение ε = ki [m]. На этом основании можно
сделать вывод о том, что выполнение соотношения d lgεi / d lg[m] = 1 может служить не только указанием на выполнение закона Генри, но и арбитражным признаком установления равновесия за время сорбции между формами состояния химически неоднородного микрокомпонента – сорбата. В данном случае коэффициент распределения будет характеризовать сорбирующуюся форму
(рис.6.2.).
Сорбат – микрокомпонент представлен несколькими формами, между которыми отсутствует подвижное равновесие.
Сорбат, для которого отсутствует лабильная связь между формами состояния, называется инертным сорбатом:
M z+ ← ML1(z-1)+ ← ML2(z-2)+ ← MLz0 ← ← MLn (z-n)-
(знак → показывает невозможность получения i формы из формы i-1). Для инертного сорбата взаимопревращение одних форм состояния в другие происходит крайне медленно по сравнению со
скоростью сорбции.
Отсутствие подвижной связи, наиболее характерное для коллоидных и полимерных форм состояния сорбата, приводит к нарушению динамического равновесия между формами, так что αi = f[m] ≠ const. При этом можно считать, что все формы состояния сорбата в процессе межфазного распределения ведут себя независимо друг от друга. Каждый сорт будет характеризоваться своими
90

значениями ki и αi. Если в сорбционной системе все время увеличивать [m], то в процессе сорбции будут вовлекаться все более
слабосорбируемые формы, и величина |
|
n |
будет уменьшаться, |
||||
|
= ∑kiαi |
||||||
K |
|||||||
|
|
|
|
|
|
i=1 |
|
т.е. в такой системе: ∂lg |
|
/∂lg[m] < 0 и ∂lgε/∂lg[m] < 1. |
|||||
K |
|||||||
Тогда, если сорбат неоднороден и инертен, то изотерма сорбции |
|||||||
в координатах «lg |
|
– lg[m]» будет |
|
иметь |
сложный профиль, |
||
ε |
|
||||||
характеризующийся тем, что при больших значениях [m] угловой коэффициент касательной к изотерме отклоняется от единицы в меньшую сторону. Конкретные особенности изотермы (общий вид, экстремальные точки, наибольшие значения ε) будут зависеть от многих факторов – числа разносорбирующихся сортов, их долей, генриевских констант и т.д. Наиболее характерные изотермы инертного сорбата приведены на рис. 6.3 – 6.5. В случае реализации модели инертного сорбата метод переменной массы сорбента позволяет как получить количественные характеристики состояния микрокомпонента в растворе, так и оценить сорбционные свойства отдельных форм состояния (ki).
Таким образом, анализ изотермы сорбции в координатах «lgε - lg[m]» позволяет не только корректно определить коэффициент распределения, но и сделать вывод о формах состояния микрокомпонента в растворе. Если изотерма представляет собой прямую с тангенсом угла наклона, равным 1, то это указывает на то, что сорбат является моносортовым или полисортовым, лабильным. Значение коэффициента распределения будет характеризовать сорбирующую форму. Если изотерма сорбции имеет сложный профиль, или тангенс угла наклона с учетом погрешности определения меньше 1, то это указывает на то, что сорбат сложный, инертный. Значение коэффициента распределения будет характеризовать сорбирующуюся форму (участки с единичным угловым коэффициентом на рис. 6.3 – 6.4) или являться брутто коэффициентом распределения, который можно использовать для описания процесса распределения в тех же самых условиях, но нельзя приписывать никакой из форм.
91
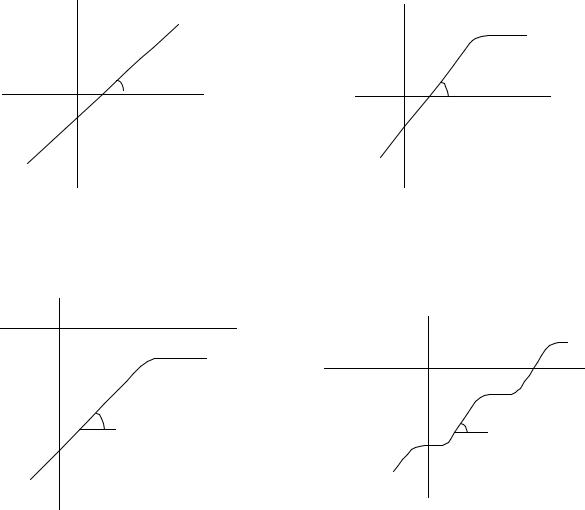
lg ε |
|
|
lg ε |
α |
α |
|
lg [m] |
|
lg [m] |
|
tg α = 1 |
tg α = 1 |
|
Рис.6.2 Моносортовой или сложный Рис.6.3 Сложный инертный сорбат. |
|
лабильный сорбат |
Имеются несорбирующие сорта |
lg ε |
lg ε |
|
lg [m] |
|
lg [m] |
α |
α |
|
|
|
tg α = 1 |
Рис.6.4 Сложный инертный сорбат с |
Рис.6.5 Сложный инертный сорбат, |
большой долей несорбирующихся |
состоящий из небольшого числа |
сортов |
сорбирующихся сортов, резко |
|
отличающихся значениями ki |
2. Краткая характеристика исследуемой системы
В данной работе исследуется состояние тория в растворе нитрата уранила. При химической переработке урансодержащей руды радиоактивное равновесие будет полностью нарушено, поэтому в соли урана и ее растворе будет представлены дочерние радионуклиды начала ряда:
238 |
α |
|
|
|
234 |
β |
− |
|
234 |
UX |
2 |
|
β |
− |
|
234 |
α |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
U |
|
|
|
→ |
Th |
|
|
→ |
91 |
Pa |
|
|
|
|
→ |
U |
|
→ |
|
9 |
|
24,1дн |
|
1,17мин |
5 |
||||||||||||
92 |
4,5×10 |
л |
90 |
|
UZ |
|
|
|
92 |
|
||||||||
|
|
|
|
|
|
92 |
|
|
|
6,7час |
|
|
≈10 л |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Радиоактивное равновесие в данной части |
ряда будет |
восстановлено полностью в течение 240 суток. |
|
Вкачестве сорбента предлагается использовать гидратированный диоксид марганца, осажденный в виде тонкого слоя на целлюлозу. Гидратированный диоксид марганца проявляет свойства слабокислотного катионита. Следовательно, в процессе ионного обмена будут извлекаться катионные формы сорбата. В растворе торий может быть представлен или формой гидратированного катиона или гидроксоформами, поэтому определяющее влияние на формы состояния тория будет оказывать рН раствора, значение которого ограничено гидролизом уранил-иона.
3.Порядок выполнения работы
В5 пробирок помещают навески сорбента в 10, 25, 50, 100 и 250
мг, наливают по 10 мл раствора UO2 (NO3)2 (рН= 2 – 4), нумеруют пробирки и ставят на мешалку.
Из исходного раствора отбирают 2 пробы по 0,5 мл для определения скорости счета исходного раствора. Через полчаса растворы с сорбентом снимают с мешалки. Из каждой пробирки отбирают 2 пробы по 0,5 мл, начиная с раствора, в котором была наибольшая навеска. Все отобранные пробы, включая исходную, сушат в сушильном шкафу и измеряют по β-счету на установке УМФ-2000 2 раза в течение 1 минуты, получая значения скорости счета, имп/мин. Результаты прямых измерений и их обработки заносят в таблицу 6.2.
|
|
Результаты прямых измерений и их обработки |
Таблица 6.2 |
|||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Пробы, |
|
I, имп/мин |
|
|
I |
, имп/мин |
S2 |
|
I |
|
п/п |
1 |
2 |
3 |
4 |
|
|
|
|
|
|
Iф |
|
|
|
|
|
|
|
|
|
|
I0 |
|
|
|
|
|
|
|
|
|
|
Iр1 |
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
Iр5 |
|
|
|
|
|
|
|
|
|
|
Отработанные растворы UO2 (NO3)2 отдают лаборанту.
93
