
Лабораторные работы / 1
.docxФГАОУ ВО «Уральский федеральный университет имени первого
Президента России Б.Н. Ельцина»
Химико-технологический институт
Кафедра машины и аппараты химических производств
Отчёт
Лабораторная работа № 1
Изучение процесса абсорбции.
Преподаватель |
Хомякова Т.В. |
|
Студент |
Хитрых А.В. |
|
Группа |
Фт-320016 |
|
Екатеринбург
2025 г.
ЦЕЛЬ РАБОТЫ
Изучение процесса абсорбции, определить конечное количество кислорода в воде.
ЗАДАЧИ РАБОТЫ
Понять основные принципы процесса абсорбции.
Рассчитать конечное количество кислорода в воде.
Построить графики зависимости конечной концентрации кислорода в воде от расхода кислородной смеси и зависимости конечной концентрации кислорода в воде от времени.
Сделать выводы.
ОСНОВНЫЕ СВЕДЕНИЯ
Абсорбция — это процесс избирательного поглощения газа из смеси газов (или пара из парогазовой смеси) жидким поглотителем. В абсорбционных процессах участвуют две фазы: газовая и жидкая. При абсорбции происходит переход вещества из газовой фазы в жидкую. Обратный процесс называется десорбцией, при котором вещество переходит из жидкой фазы в газовую.
Равновесие в процессах абсорбции определяет состояние, устанавливающееся при продолжительном соприкосновении фаз, и зависит от состава одной из фаз, температуры, давления и термодинамических свойств компонента и поглотителя.
Для каждой конкретной системы газ-жидкость при определенной температуре и давлении существует строго определенная зависимость между равновесными концентрациями. Эта зависимость может быть представлена в виде функции:
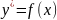
Для разбавленных растворов хорошо растворимых газов равновесная зависимость хорошо описывается законом Генри:
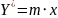 ,
где
,
где
m — константа фазового равновесия, величина которой зависит от природы газа и жидкости, и единиц, в которых выражены концентрации.
Закон Генри описывает равновесную зависимость между концентрацией газа в жидкости и его парциальным давлением над жидкостью. Константа m зависит от природы газа и жидкости, а также от температуры. Этот закон применим для разбавленных растворов хорошо растворимых газов.
Уравнение материального баланса абсорбера:
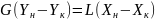
Уравнение описывает баланс массы в абсорбере, где G — расход инертного газа, L — расход абсорбента, YH и YK — начальная и конечная концентрации газа, а XH и XK — начальная и конечная концентрации абсорбента. Уравнение позволяет определить, как изменяется количество газа в системе при его поглощении жидкостью.
Если исходный абсорбент не содержит
распределяемый компонент (XH
= 0), то

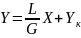
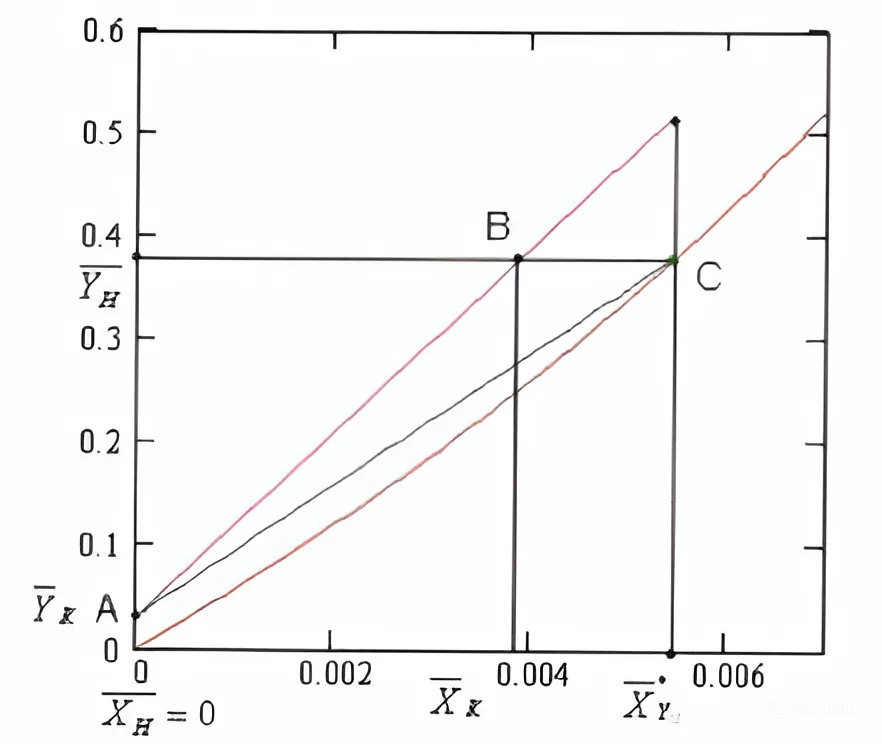
Рисунок 1 – График процесса абсорбции
ОС – линия равновесия у*= f(х);
АВ – рабочая линия – прямая, проходящая через точки (УН, ХК) и (УК, ХН).
Полученная зависимость называется уравнением рабочей линии. Это уравнение позволяет определить значение рабочей концентрации в любой точке аппарата.
Движущая сила абсорбции — это разность между рабочей и равновесной концентрациями вещества в фазе. Она изменяется по высоте абсорбера и может быть выражена как среднелогарифмическая величина разности концентраций на концах аппарата.
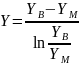
Основное уравнение массопередачи описывает передачу массы через поверхность контакта фаз.
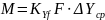
M — количество передаваемого компонента,
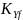 — коэффициент массопередачи,
— коэффициент массопередачи,
F — поверхность контакта фаз,
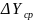 — средняя движущая сила.
— средняя движущая сила.
Описание и принцип работы лабораторной установки
Схема лабораторной установки для изучения процесса абсорбции на рис.2.
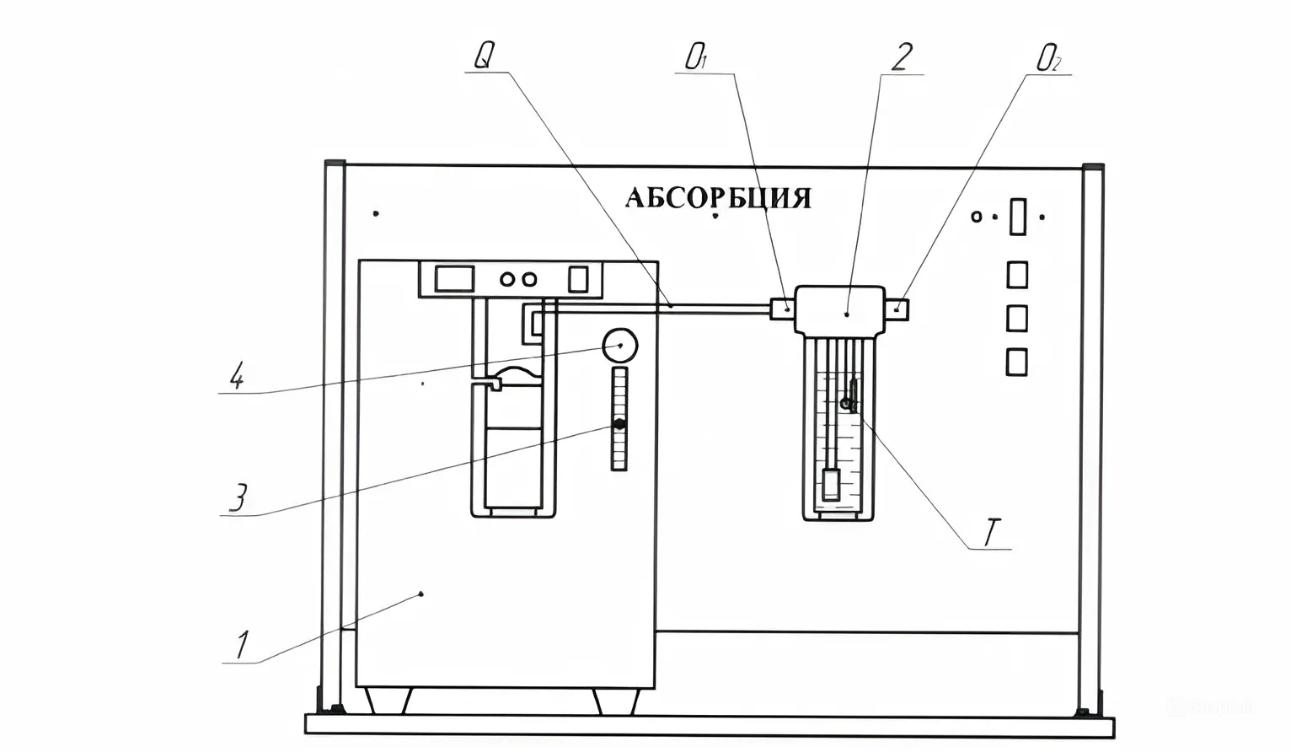
Рисунок 2 – Лабораторная установка для изучения процесса абсорбции
1 – концентратор кислорода, 2 – рабочая емкость, 3 – расходомер
кислородной смеси, 4 – регулятор расхода кислородной смеси
Замеряемые параметры:
Q1, Q2 – датчики кислорода;
Q – расход кислорода;
Т – температура внутри рабочей емкости.
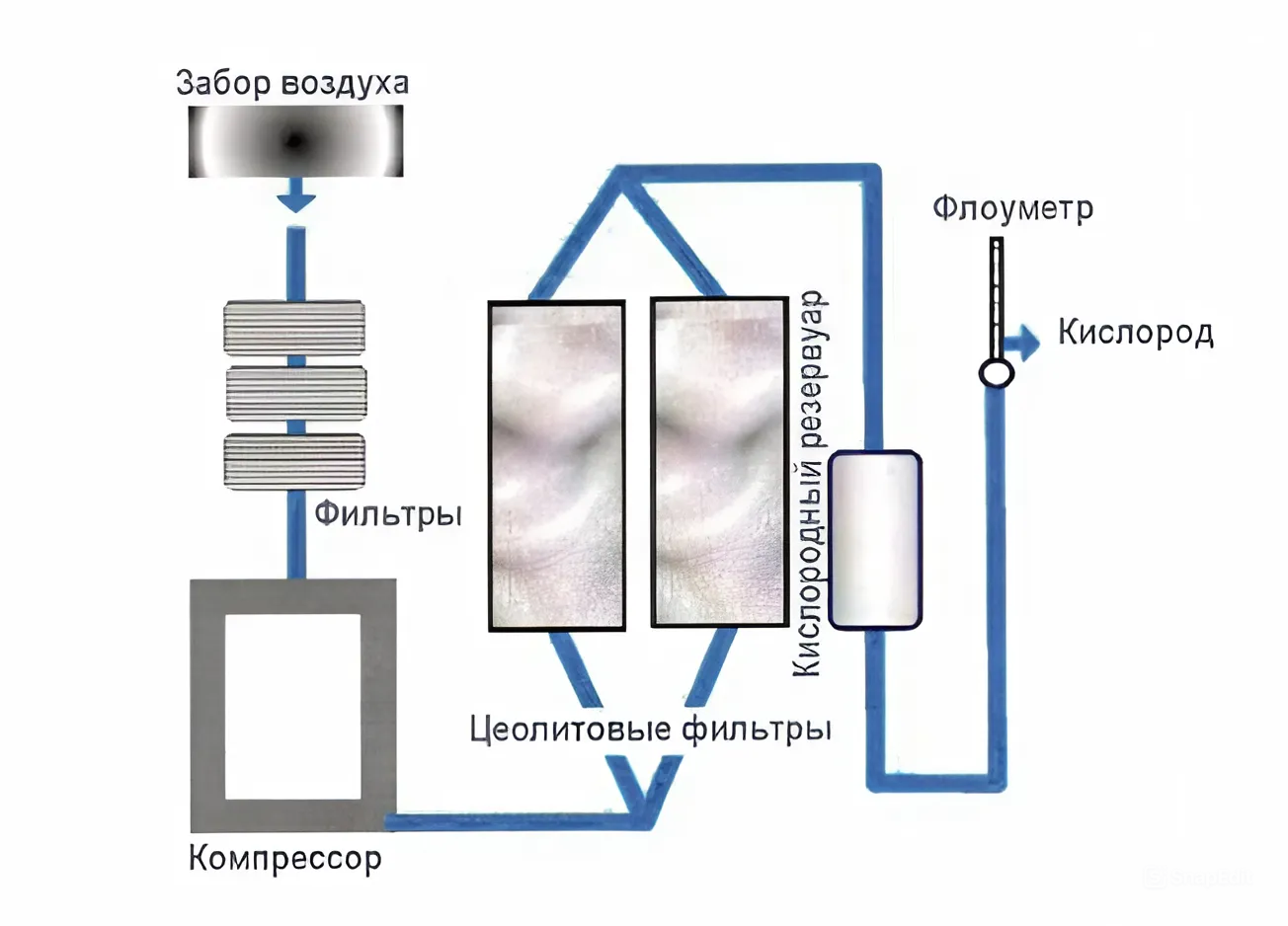
Рисунок 3 – Принцип работы концентратора кислорода
В основе принципа работы концентратора кислорода лежит физическое разделение газов из смеси при комнатной температуре (рис. 3).
Принцип работы установки:
Воздух всасывается и сжимается, проходя через фильтры и цеолитовую колонну, где азот удаляется, а кислород проходит дальше.
Кислород поступает в рабочую ёмкость с водой, где происходит его абсорбция.
Датчики измеряют концентрацию кислорода на входе и выходе, что позволяет оценить эффективность абсорбции.
Таймер позволяет установить время работы установки, после чего она автоматически отключается.
ОБРАБОТКА РЕЗУЛЬТАТОВ
Данные, полученные в ходе эксперимента, а также рассчитанные по его результатам, представлены в таблице 1.
Таблица 1 – Результаты измерений и вычислений
№ п/п |
G, л/мин |
t, °C |
V, м3 |
τ, мин |
YН, кмоль |
YК, кмоль |
L, м3/ч |
XН, кмоль |
ХК, кмоль |
1 |
3,5 |
23,3 |
0,0005 |
0 |
39,2 |
29,9 |
0,00 |
0 |
0,00 |
2 |
1 |
39,7 |
33,4 |
1,80 |
0,74 |
||||
3 |
2 |
39,5 |
34,2 |
0,90 |
1,24 |
||||
4 |
3 |
39,4 |
34,0 |
0,60 |
1,89 |
||||
5 |
4 |
39,4 |
33,8 |
0,45 |
2,61 |
||||
6 |
5 |
39,4 |
33,7 |
0,36 |
3,33 |
||||
7 |
6 |
39,2 |
33,5 |
0,30 |
3,99 |
||||
8 |
7 |
39,0 |
33,4 |
0,26 |
4,57 |
||||
9 |
5 |
0 |
34,7 |
20,0 |
0,00 |
0,00 |
|||
10 |
1 |
32,9 |
27,0 |
1,80 |
0,98 |
||||
11 |
2 |
32,8 |
27,7 |
0,90 |
1,70 |
||||
12 |
3 |
32,7 |
27,6 |
0,60 |
2,55 |
||||
13 |
4 |
32,7 |
27,6 |
0,45 |
3,40 |
||||
14 |
5 |
32,8 |
27,5 |
0,36 |
4,42 |
||||
15 |
6 |
32,6 |
27,5 |
0,30 |
5,10 |
||||
16 |
7 |
32,7 |
27,4 |
0,26 |
6,18 |
Выкладка расчётов
Перевод расхода воздушной смеси из л/мин в м3/ч:
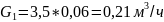
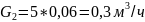
Перевод объёма из мл в м3:
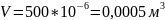
Пример перевода времени из минут в часы:
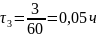
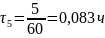
Пример расчёта расхода воды:
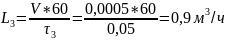
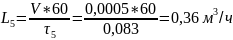
Пример расчёта конечной концентрации кислорода в воде:
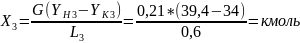
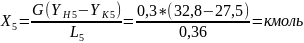
По рассчитанным результатам были построены: график зависимости конечной концентрации кислорода в воде от расхода кислородной смеси (Рис.4) и график зависимости конечной концентрации кислорода в воде от времени (Рис.5).
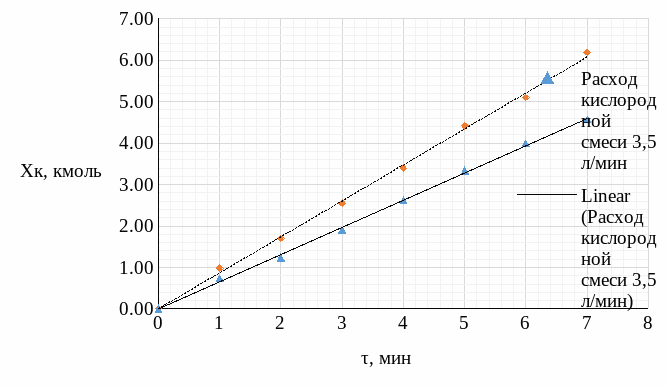
Рисунок 4 – График зависимости конечной концентрации кислорода в воде от времени
Выводы
По итогам лабораторных измерений была рассчитана конечная концентрация кислорода в воде, построены соответствующие графики зависимости.
На основе построенных графиков можно сказать, что при увеличении расхода газовой смеси, концентрация кислорода в воде значительно возрастает. За одно и то же время работы установки, при расходе газовой смеси в 5 л/мин, было достигнуто более высокое насыщение воды кислородом, чем при меньшем расходе.
