
Лаба 2 / 0421_Токарев_отчет_ЛР2
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
по лабораторной работе №2
по дисциплине «Химия»
Тема: Определение молярной массы эквивалента металла
Студент гр. 0421 |
|
Токарев А.А. |
Преподаватель |
|
Васильев Б.В. |
Санкт-Петербург
2020
Цель работы: определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл.
Основные теоретические положения
Эквивалент - реальная или условная частица, равноценная одному атому водорода в простых веществах и соединениях, а также одному иону водорода (H+) в кислотно-основных реакциях и одному электрону в окислительно-восстановительных процессах. То есть эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Молярная масса эквивалента - масса 1 моль (6.02 1023) эквивалентов данного вещества. Единица измерения молярной массы эквивалента – г/моль эквивалентов. Исходя из понятия эквивалента она связана с молярной массой (M) следующим соотношением: MЭ = fЭM (например Э(H2) = 1/2 H2, следовательно MЭ(H2) = 1 г/моль эквивалентов).
Закон эквивалентов - Закон эквивалентов относится к основным стехиометрическим законам химии, на которых основано атомномолекулярное учение: вещества взаимодействуют между собой равным числом эквивалентов. Закон эквивалентов описывается выражением:
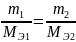
m1, m2 - массы взаимодействующих веществ, г; а MЭ1, МЭ2 - молярные массы их эквивалентов, г/моль эквивалентов.
Схема установки:
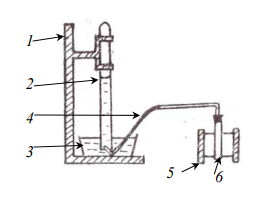
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты приведена на рисунке выше, где обозначены: 1 штатив для эвдиометра; 2 эвдиометр; 3 кристаллизатор; 4 газоотводная трубка; 5 штатив для пробирки; 6 пробирка.
Протокол наблюдений
Лабораторная работа № 2
«Определение молярной массы эквивалента металла»
Вариант: 14
Температура опыта – 24 °С
Атмосферное давление опыта – 755 мм рт. ст.
Навеска металла (m), г |
Температура опыта (T1), К |
Атмосферное давление опыта (pатм), Па |
Парциальное давление водяного пара
|
Объем выделившегося водорода (V1), л |
Парциальное давление водорода
|
0,0218 |
297 |
100658 |
2983,2 |
0,0310 |
97674,8 |
Обработка результатов
1. Приведем объем выделившегося водорода к нормальным условиям (н. у.):
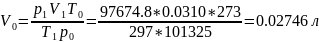
2. Рассчитаем молярную массу эквивалента металла, используя закон эквивалентов:
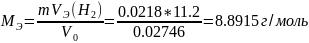
3. Определим молярную массу атомов металла:
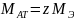
z=1: Мат1 = zMЭ = 1 * 8.8915 = 8.8915 г/моль
z=2: Мат2 = zMЭ = 2 * 8.8915 = 17.7830 г/моль
z=3: Мат3 = zMЭ = 3 * 8.8915 = 26.6745 г/моль
Предположим, что исходный металл – алюминий, Мэктеор = Ма(Al) / V(Al), где Ма – атомная масса, V – валентность.
Мэктеор = 26.9815 / 3 = 8.9938 г/моль
4. Вычислим абсолютную и относительную погрешности определения молярной массы эквивалента металла:
Абсолютная погрешность:
Мэктеор - Мэкпр = 8.9938 – 8.8915 = 0.1023 г/моль
Относительная погрешность:
|Мэктеор - Мэкпр| / Мэктеор * 100 % = 0.1023/8,9938 * 100% = 1.14%
5. Приведем уравнения окислительно-восстановительной реакции:
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + 6H+ + 6Cl- → 2Al3+ + 6Cl- + 3H2↑
2Al + 6H+ → 2Al3+ + 3H2↑
2Al0 – 6e- → 2Al+3 – окисление
6H+ + 6e- → 6H0 – восстановление
Выводы:
В проведенной работе был исследован метод определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты. С помощью закона эквивалентов была установлена расчетная молярная масса эквивалента металла. С помощью таблицы Менделеева(атомная масса и валентность) и ряда активности металлов(отбросили все щелочные металлы и выбирали из металловЮ которые стоят в ряду активности до водорода) был установлен исследуемый металл – алюминий. Расчетная молярная масса эквивалента алюминия была определена с абсолютной погрешностью в 0.1023 г/моль и с относительной погрешностью в 1.14%. Погрешность связана с неидеальными условиями проведения опыта (потери при округлении данных, потери за счет нагревания окружающей среды).

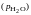 ,
Па
,
Па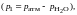 Па
Па