
МУ Задачи по ККП
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Филиал в г. Стерлитамаке
Кафедра общей химической технологии
Кинетика и катализ в промышленности:
сборник задач
Учебно-методическое пособие
Уфа
2012
Задачи по дисциплине «Кинетика и катализ в промышленности» предназначены для текущего контроля студентов, обучающихся по специальности 240401 «Химическая технология органических веществ».
Составитель: Касьянова Л.З., канд. хим. наук, доцент
Рецензент: Исламутдинова А.А., канд. техн. наук, доцент
Уфимский государственный нефтяной технический университет, 2012
Задача 1. Найти рабочую скорость псевдоожиженного каталитического слоя следующим гранулометрическим составом:
Размер частиц, мм массовая доля фракции, %
≥ 0.5 1,35
0.5-0,4 2,0
0.4-0,3 3,5
0,3-0,2 5,0
0,2-0,1 45,0
0,1-0,05 20,0
0,05-0.025 10,0
0,025-0,01 13,15
Итого: 100 %
Линейная скорость газа -0,5 м/сек;
линейная скорость катализатора -0,003 м/сек;
плотность газа- 0,4 кг/м3;
плотность катализатора 0,95 кг/м3;
кинематическая вязкость газов -98.1х10-6 м2/сек.
Задача 2. Какую долю общей поверхности занимает металл, если катализатор реформинга содержит кристаллиты размером 12А на оксиде алюминия, площадь поверхности которого 200 м2/г? Если кристаллиты металла равномерно распределены на поверхности оксида алюминия, то какое среднее расстояние между ними?
Задача 3. Реформинг протекает в реакторе, температура на входе в который 482 °С, а давление 34 атм. Сырье содержит в основном водород. Температура на выходе 454 °С. С применением нового катализатора реактор будет иметь температуру на входе 510 °С, общее давление 13,6 атм. (парциальное давление водорода 10,2 атм.). Считая, что реагирующий углеводород состоит из соединений четырех классов (ароматические углеводороды, циклопарафины, изопарафины и н-парафины), предскажите влияние изменения условий на равновесие, кинетику реакций и температурный профиль в реакторе.
Задача 4. Вейс, используя методику смешанных катализаторов, изучил конверсию н-гексана в изогексаны на смеси Pt/SiO2 и алюмосиликата и получил результаты, представленные в таблице 1.
Таблица 1. Изомеризация н-гексана в присутствии
грубых смесей катализатора1.
Катализатор, загружаемый в реактор |
Конверсия в изогексаны, % |
10 см3 Pt/SiO2 10 см3 SiO2 – Al2O3 Смесь 10 см3 Pt/SiO2 и 10 см3 SiO2 – Al2O3 |
0,9 0,3 6,8 |
1 – Условия реакции: 3730С, общее давление – 1атм, 17,2г н-гексана/г, мольное соотношение Н2 : н-гексан = 5,0 |
|
Максимальная (равновесная) конверсия н-гексана в гексен составляет 0,04%, если образуется олефин только нормального строения, и 0,6%, если дегидрогенизация протекает с участием всех изомерных олефинов. Если средний диаметр частиц 0,6 мм и коэффициент диффузии в частицах катализатора 2∙10-3 см2/с, определите, в какой степени диффузия может лимитировать реакцию.
Задача
4. Этилен,
выходящий при крекинге нефти, содержит
небольшое количество ацетилена, который
необходимо удалять перед использованием
этилена. Такое удаление обычно проводят
путем гидрирования ацетилена на металле
в присутствии этилена. Селективность
гидрирования ацетилена определяют как:
 где
ri
– скорость гидрирования частиц i.
где
ri
– скорость гидрирования частиц i.
Селективность гидрирования ацетилена в ацетилен-этиленовой смеси можно значительно улучшить путем добавления к сырью небольших количеств серы. Объясните эффект.
Задача 5. Дейтерирование (конверсия с D2) этилена на Pt и на Ru приводит к распределению продуктов представленных в таблице 2. Какие выводы можно сделать о взаимодействии олефина с поверхностью металла? Что можно предположить в качестве возможного механизма для объяснения этих данных?
Таблица 2. Наблюдаемое распределение дейтерированных продуктов (в мольных долях) в реакции С2Н4 с D2
Продукт |
Условия |
|
Pt, 1020С |
Ru, 320С |
|
C2H3D3 C2H4D2 C2H5D C2H6 C2H2D2 C2H3D |
7,5 26,8 24,3 9,5 4,5 19,6 |
2,1 41,6 10,4 2,2 0,9 42,8 |
Задача 6. Постулируется, что гидрирование этилена на поверхности металлов протекает через следующие стадии:

К2
где Х соответствует Н или D. Предположите метод анализа, чтобы получить отношение констант скоростей изотопного распределения в продуктах дейтерирования этана. При анализе необходимо принять, что Х есть D в стадиях 3,4,5.
Используя данные предыдущей задачи, определите отношения k3/k2 и k5/k4.
Задача 7. Представьте использование Н2О в качестве донора кислорода вместо О2, написав реакцию
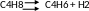
как
 (а)
(а)
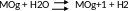
(б)
где МОg+1 – оксидный катализатор, который может отдавать О с образованием МОg
Исходя
из теории Баландина, следует ожидать,
что максимум активности будет при равных
скоростях реакций (а) и (б). Выразите этот
критерий математически, предполагая,
что изменения стандартных свободных
энергий двух реакций одинаковы. Эти
выражения содержат
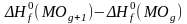 ;
рассчитайте эту величину и проверьте,
какой оксид удовлетворяет критерию.
Проверьте, согласуется ли этот результат
с обычно используемым катализатором.
;
рассчитайте эту величину и проверьте,
какой оксид удовлетворяет критерию.
Проверьте, согласуется ли этот результат
с обычно используемым катализатором.
Задача
8. Температура
реакции, при которой можно получить
бутадиен, равна 6270С.
Рассчитайте из данных предыдущей задачи
отношение
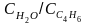 ,
чтобы получить 50 %-ную конверсию при
этой температуре и давлении 1 атм. Что
получится с
,
чтобы получить 50 %-ную конверсию при
этой температуре и давлении 1 атм. Что
получится с
 - катализатором, если это соотношение
равно 0.
- катализатором, если это соотношение
равно 0.
Задача 9. При газификации кокса пар используется как донор кислорода для образования Н2. Используйте бензол в качестве модели кокса и представьте реакцию как

Примените метод, данный в задаче 7 для нахождения возможного оксидного катализатора. Какова причина того, что Н2О не всегда используется в окислении?
Задача
10.
Найдено, что реакция
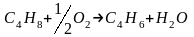 при
температурах выше 400 °С и в присутствии
висмутмолибдатных катализаторов имеет
первый порядок по парциальному давлению
бутена с энергией активации около 12
ккал/моль. При более низких температурах
скорость уменьшается гораздо быстрее,
чем предсказано уравнением Аррениуса,
что обычно относит к ингибированию
получаемым бутадиеном. Матсуура нашел,
что теплота адсорбции бутадиена около
23 ккал/моль. Составьте уравнение скорости
Лангмюра-Хиншельвуда для реакции и
выведите кинетику при температуре около
200
°С,
для которых поверхностное покрытие
бутадиеном почти полное: выведите
энергию активации для этой температуры.
Существует ли альтернативное объяснение
увеличения энергии активации?
при
температурах выше 400 °С и в присутствии
висмутмолибдатных катализаторов имеет
первый порядок по парциальному давлению
бутена с энергией активации около 12
ккал/моль. При более низких температурах
скорость уменьшается гораздо быстрее,
чем предсказано уравнением Аррениуса,
что обычно относит к ингибированию
получаемым бутадиеном. Матсуура нашел,
что теплота адсорбции бутадиена около
23 ккал/моль. Составьте уравнение скорости
Лангмюра-Хиншельвуда для реакции и
выведите кинетику при температуре около
200
°С,
для которых поверхностное покрытие
бутадиеном почти полное: выведите
энергию активации для этой температуры.
Существует ли альтернативное объяснение
увеличения энергии активации?
Задача 11. Предложите конструкцию реактора гидрообессеривания легких фракций, содержащих 50 м.д. тиофена и 150 м.д. меркаптанов (1м.д. = 10-4 % = Ред.), сульфидов и дисульфидов. Предполагается, что парофазные реагирующие вещества контактируют с катализатором при 370 °С и 20 атм с молярным отношением водород/углеводород, равным 1. Концентрация серы в продукте должна составлять 0,5 м.д. Старением катализатора в этих условиях можно пренебречь.
Задача 12.Одним из побочных продуктов в промышленном процессе карбонилирования метанола является СО2. Предложите механизм образования этого продукта.
Задача 13.Когда (RuCl4)3- вступают в контакт ацетиленом и водой, в результате каталитического анализа ацетилен гидратируется с образованием ацетальдегида. Предложите схему каталитического цикла.
Задача 14. Несмотря на то, что реакции крекинга эндотермичны, равновесные конверсии в процессах крекинга могут быть высокими. Что можно сказать об изменении энтропии в реакциях крекинга.
Задача 15. Образование ультрастабильного цеолита HY (отношением Si/Al=2,5) приводит к удалению 24 катионов алюминия из каждой ячейки. Большая часть возникающих катионных вакансий заполняется кремнием, что приводит к уменьшению ячейки и стабилизации цеолита. Допустим , что кристаллиты цеолита имеют сферическую форму и диаметр 1,5 мкм и что кремний извлекается из поверхностной области. Какая доля кристаллита должна была бы разрушиться, что бы обеспечить наличием требуемого количества кремния при условии, что весь кремний из внешней области мигрирует к центру кристаллита?
Задача 16. Рассмотрим образец порошка Н-морденита, частицы которого имеют поры 10 мкм. Имеется приблизительно 4,0*1016 дор на 1 г образца. Установлено, что 1 г морденита адсорбирует 0,087 г бензола или 0,068 г кумола.
а) Исходя из геометрических параметров молекул, покажите, можно ли считать, что эти величины реально соответствуют насыщению структуры пор. Обсудите характер расположения ароматических молекул в порах Н-морденита?
б) Какое предположение можно сделать о встречной диффузии этих двух частиц в порах Н-морденита?
в) Какое количество криптона может адсорбироваться в порах Н-морденита?
Задача 17. Каталитический крекинг тяжелого сырья зависит от скорости потока через контактное пространство, которая определяется в единицах (объем сырья)/[ч*(объем катализатора)]. Такую зависимость подтверждают данные, приведенные в табл. 3.
Таблица 3
Продукт, масс, τ |
Скорость потока, см3/(см3*ч) |
|||
0,1 |
0,5 |
1,0 |
2,0 |
|
Н2+парафины(С1-С4)+олефины |
22,9 |
15,7 |
11,9 |
8,9 |
Бензин (С5+более тяжелые углеводороды) |
43,2 |
33,7 |
30,4 |
25,0 |
Кокс |
11,0 |
3,9 |
2,5 |
1,8 |
Общее количество продуктов |
77,1 |
55,3 |
44,8 |
35,7 |
Непревращенное сырье, масс, % |
23,0 |
44,7 |
55,2 |
64,3 |
Какие кинетические выражения лучше всего соответствуют данным для реакции коксообразования и наиболее точно описывают данные по крекингу?
Задача 18. Суэбб и Гейтс исследовали явление реакции-диффузии в кристаллитах Н-морденита. Они измерили скорость дегидратации метанола с образованием диметилового эфира, используя катализаторы с различным размером кристаллитов. Обсудите представленные ниже данные в терминах модели Тиле, согласно которой реакция протекает по первому порядку, Какова величина эффективного коэффициента диффузии метанола в парах морденита?
Размер пор катализатора, мкм |
Скорость дегидратации метанола при 2050С и 1 атм, число молей превращенного метанола на 1г катализатора в 1с |
5,9
11,3 4,3
16,6 5,7 |
(7,33
(6,17
4,94*10-4 |
Задача 19. Параскос сообщил о гидрообессеривании нефтяных остатков с образованием продуктов, в которых концентрация серы сохранялась постоянной при повышении температуры катализатора с целью компенсации его старения. Авторы наблюдали, что выход жидких продуктов в определенном диапазоне кипения уменьшался в течение относительно короткого времени работы, проходя через минимум, и затем увеличивался с увеличение температуры. Что можно сказать на основании этих результатов о химизме гидрокрекинга?
Задача 20. Активность катализатора в гидрокрекинге сильно понижается, если исходное сырье содержит высокие концентрации таких веществ, как хинолин. Объясните , почему следует проводить процесс гидроочистки, что бы свести к минимуму этот эффект?
Задача 21. Предложите механизм для объяснения результата, полученного Маковским и др. показавших , что в реакции между тиофеном и D2 первоначально образуется H2S.
Задача 22. В процессе гидрообессеривания дистиллятов, используемых в качестве сырья для реакторов реформинга, было обнаружено, что повышение температуры в реакторе, предназначенное для увеличения конверсии, обычно приводит к понижению конверсии, даже если старение катализатора заметно не ускоряется. Объясните эти наблюдения.
Задача 23. Полагают, что, реакция тиофена на катализаторе гидрообессеривания, протекает через адсорбцию, включающую взаимодействие атома серы с атомной вакансией поверхности. Подразумевая, что ароматические вещества, такие, как бензол, являются ингибиторами реакции гидрообессеривания и также подвергаются гидрогенезации, предложите альтернативный способ адсорбции тиофена и других ароматических серусодержащих соединений. Какие доказательства существуют в подтверждении каждой из двух моделей адсорбции?
Задача 24. Какие изменения поверхности катализатора гидрообессеривания можно ожидать при изменении отношения парциальных давлений водорода и H2S?
Литература
Промышленный катализ в лекциях./ Под ред. А.С. Носкова.-М.: Калвис. Вып. 3-2006
Тименов И.Ф. Изучение кинетики химических реакций в прикладных целях.-М.: Янус-К, 2008
Роминовский Б.В. Основы химической кинетики. Учеб.-М.: Экзамен, 2006
Содержание
Задачи 3
Литература 9

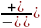 3,2
3,2 )*10-4
)*10-4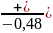 )*10-4
)*10-4