
- •Катализаторы стратегическая продукция
- •Катализаторы стратегическая продукция
- •России 16
- •Катализаторы стратегическая продукция
- •Катализаторы стратегическая продукция
- •Катализаторы стратегическая продукция
- •Катализаторы стратегическая продукция
- •РОССИЙСКИЕ ПРОИЗВОДИТЕЛИ КАТАЛИЗАТОРОВ
- •Прогнозируемая годовая потребность России в катализаторах гидроочистки
- •Современное состояние и направления развития катализаторов гидроочистки
- •Исторические корни катализа
- •Исторические корни катализа
- •Исторические корни катализа
- •Становление катализа
- •Основные положения определения катализа
- •Основные положения определения катализа
- •Роль катализа в становлении и развитии современной промышленности
- •Роль катализа в становлении и развитии современной промышленности
- •Роль катализа в становлении и развитии современной промышленности
- •Катализ в решении проблем энергетики
- •Катализ в решении проблем энергетики
- •Катализ в решении проблем энергетики
- •Катализ в решении проблем экологии
- •Катализ в живой природе
- •Катализ в живой природе
- •Классификация катализаторов
- •Классификация катализаторов
- •Классификация катализаторов
- •Классификация каталитических процессов
- •Понятие о каталитическом цикле
- •Каталитическая активность
- •Селективность каталитического процесса
- •Лекции 1, 2
- •Для рентабельной эксплуатации катализатор должен обладать
- •Стабильность
- •дисперсность
- •Механическая прочность
- •Определение и характеристики пористых материалов.
- •Супрамолекулярная структура пористого материала.
- •классификации пористых тел по размерам пор
- •Морфология пористых тел
- •СИНТЕТИЧЕСКИЕ ЦЕОЛИТЫ
- •СИНТЕТИЧЕСКИЕ ЦЕОЛИТЫ
- •Коллоидная затравка
- •Схема комплексного подхода к решению основ промышленного производства катализаторов.
- •Традиционные методы синтеза пористых материалов - катализаторов
- •Основные параметры и факторы осаждения
- •Технологии приготовления никелевых катализаторов гидрирования
- •При смешивании всех компонентов в аппарате поз. 127/2 происходят
- •Восстановительное разложение основного карбоната никеля (активация)
- •Технология приготовления катализаторов гидрирования методами осаждения через
- •Технология приготовления. Алюмо-цинк-медные катализаторы гидрирования
- •Физико-химические основы получения пористых материалов методами нанесения
- •Способы нанесения
- •Режимы пропитки
- •раствор
- •раствор
- •Способы формовки
- •Эффективное использование поверхности катализатора
- •Зависимость поверхности контакта от геометрической формы и размера гранулы катализатора
- •Размерный эффект в катализе.
- •Методы приготовления катализаторов, основанные на механическом смешении компонентов
- •Технология производства катализаторов методами смешения
- •механохимия
- •Механохимия
- •Механохимия
- •механохимия
- •Время релаксации
- •Метод термохимической активации кристаллических веществ
- •Термохимическая активация
- •Работа катализатора
- •Формирование рабочей поверхности катализатора
- •Механизм каталитических реакций
- •Элементарные процессы в гетерогенном катализе
- •Номенклатура поверхностных интермедиатов
- •Номенклатура каталитических реакций
- •Предполагаемые стадии детального механизма реакции
- •Вначале молекулы СО и Н2 адсорбируются на поверхности медного катализатора. Затем молекулы СО
- •В присутствии никелевого катализатора как СО, так и Н2 хемосорбируются на поверхности в
- •Работа катализатора
- •Азот весьма инертное вещество. Для разрыва связи N-N в его молекуле необходима энергия
- •Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их
- •Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве
- •Дегидрирование парафинов на поверхности АЦ
- •Причины дезактивации катализаторов
- •По литературным данным, полное подавление активности
- •Дезактивация металлических катализаторов
- •Соединения фосфора являются сильными ядами, их попадание возможно из добавок к смазочным маслам,
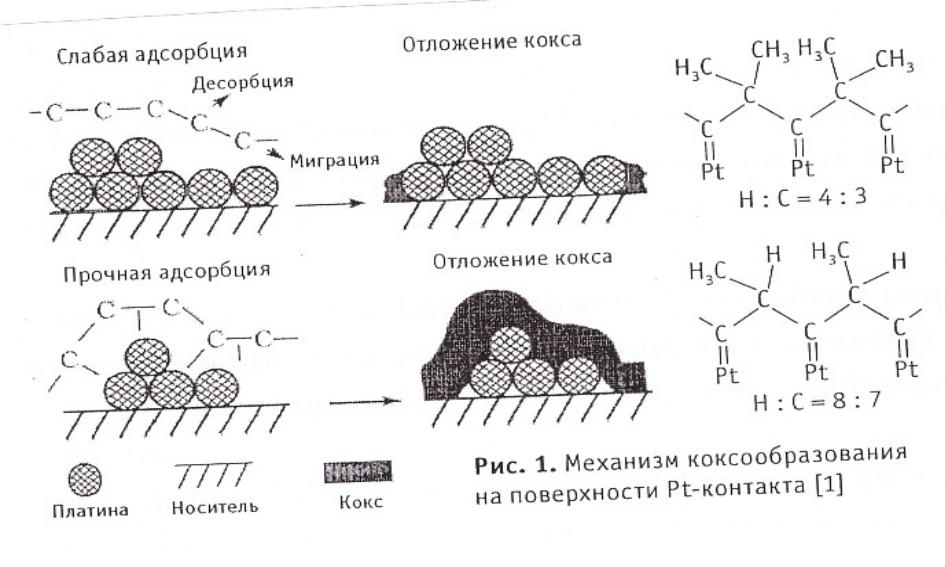
- •Блокировка поверхности коксом
- •Примеры дезактивации промышленных катализаторов
- •Способы реактивации (регенерации)
- •Гидрирование этилена
- •Реа кци я де гид р и р ов ан ия имеет тот
По литературным данным, полное подавление активности
катализатора происходит при концентрации кокса на платине от 0,07-
Лекции 1, 2 |
96 |
Дезактивация металлических катализаторов
Агрегация кристаллитов платины. Свежий катализатор содержат кристаллиты платины размером от 1 до 20 Å. В отработанном - достигают до 200÷300 Å.
спирты с кислотными центрами ведут себя подобно основаниям. Допускается реакции восстановления с выделением воды или замещение гидроксильной группы на «меркаптогруппу» (-SH) за счет взаимодействия паров спирта с сероводородом с образованием тиолов по реакции: ROH +H2S AL2O3→ RSH +H2O.
Отравляющее действие воды платиновых катализаторов на носителях с кислотными центрами многими исследователями.
Источником отравления могут служить металлы или соединения, восстанавливающийся до металлов в условиях реакции, блокируя поверхность платины. Механизм отравления установлен для мышьяка, меди, свинца и железа. Отравление протекает медленно, практически необратимо, в основном влияет на срок службы катализатора.
Лекции 1, 2 |
97 |
Соединения фосфора являются сильными ядами, их попадание возможно из добавок к смазочным маслам, используемых в насосах и других механизмах.
Аммиак, сорбируясь на кислотных центрах алюмоплатинового катализатора, снижает его активность в реакциях изомеризации.
Pt +H2S = PtS+H2 Сера образует с платиной устойчивые сульфиды
Лекции 1, 2 |
98 |

Блокировка поверхности коксом
Аморфный: С/Н =0,5-1,0; Т удаления500-550 С
Графитизированный: С/Н =1,5-2,0;Т удаления 800- 900С
Пример:
•Механизм карбидного цикла-Образование и распад карбида
• CnHm
•Fe 2O3 |
Fe |
Fe3C |
(Fe) + C |
• |
|
|
CnHm |
•Накопление кокса будет наблюдаться, если скорости его образования выше скоростей реакции его удаления.
•

Примеры дезактивации промышленных катализаторов
•Катализаторы оксихлорирования этилена дезактивируются за счет формирования низкоплавких комплексов меди. Изменение химического и фазового состава катализатора приводит к слипанию частиц. Более устойчивые катализаторы синтезируется с добавлением к хлориду меди хлорида магния.
•Дезактивация Железоокисных катализаторов дегидрирования олефинов и алкилароматических углеводородов:
• |
-Коксование, сернистые соединения блокировка АЦ (Сульфидов |
|
|
железо и калия К2S +HOH↔KSH+KOH) |
|
• |
Хлор |
изменение химического состава с образованием |
соединений промотирующих разрыв С-С связи (крекинг- Хлорид железа), образования легколетучих, легкоплавких соединений с компонентами катализатора – КСL.
•КСL, КОН –миграция -потеря компонента катализатора –изм х/с и фазового состава
Способы реактивации (регенерации)
•Способ низкотемпературного выжигания кокса с активной поверхности катализатора озоном, растворенным в сверхкритическом флюиде ( в СО2) Давление смеси О3/СК-СО2 составляло 15- 18 Мпа, температура 50С).
Гидрирование этилена
На пер в о м эт апе свобо д ны й прото н ст ре митс я к связ и с повышенной концент рацией эл ек т р он ов и ра з р ы вае т одн у связ ь между атомами углерода , обр азуя новую связь С – Н , а на втором эт ап е гидр и д - ио н ней т р а лизует по ложи тельн ы й за ряд карбока т и о на и обр а зу ет вт ору ю св яз ь С – Н .
|
H |
H |
H |
H |
H |
H |
Н2 |
H |
C C H |
H C +C H |
H |
C C H |
|

Реа кци я де гид р и р ов ан ия имеет тот же |
механизм , |
чт о и реакция г и др ир о в а н ия , то лько идущая в |
|||||||||||||||||||||||||||||||||||||||||||||||||
обратном направлении . Каковы же причины этой реакции ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
H |
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H 2 C |
|
|
C H |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
H- |
|
H + |
|
|
|
|
|
|
|
|
|
H- |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
e |
N i |
|
|
|
e |
|
|
|
|
e |
N i |
|
|
|
|
|
|
|
|
e |
N i |
e |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
П о вы ш е ни е т е мп е р ат у р ы д о 400 ° С , в о - первы х , п риводи т к |
|||||||||||||||||||||||||||||||||||||||||||||
акт и ваци и |
насыщенн о й |
|
|
молекул ы - реакта н т а , |
|
|
|
в о - вто р ы х , |
|||||||||||||||||||||||||||||||||||||||||||
п р о и с х од и т увеличен и е эне р ги и кристалл а , с о п р о в о ж д а ю щ е е с я увел и ч ен и е м а м пли т у д ы к о л е б ани й ка к р е ш е т о чны х к а т и о н о в ,
та к и э л е к т р о н о в - а н и о н о в . В определен н ы й |
мо м е н т |
в р е м ен и |
||
в о з н икае т э л е к т р и ч ес к и й дип о л ь , со с т оя щ и й |
и з п о лож и т е л ь н о |
|||
з а ряжен н о г о к а т и он а , |
яв л я ю щ е г о с я |
узло м |
к р истал л ическ о й |
|
р е ш е т к и металл а , и |
от р ицатель н о |
з а р я ж е н н о г о |
электрон а |
|
( сх е м а 43) . Эле ктро н - ан и о н , о б л а д а я ос н о вным и св о й с т в а м и , оттягивае т и о т р ы в а е т п р о т о н о т С – Н г р уп п ы насыщен н о й молекул ы с о б р а з о ва н и е м а т ом а в о дород а , п р и э т о м в м о лекул е
п р о и с х од и т пере р а с п р е де л е ни е эл е к т р о н но й |
пл о т н о с т и |
в |
|||||
сос е дн и х |
с в я з я х С – Н , |
котор о е с п о с о б с т в у е т |
форм и рован и ю |
||||
с т ру к т у р ы |
п о доб н о й |
гид р и д - и о н у |
H − , |
ко т о ры й |
с р а з у |
ж е |
|
в з а и мод е й с тв у е т с к а т и о н о м н и ке л я , о т д е л я яс ь о т ат о м а |
С . |
||||||
Да л е е г и дри д - и о н р а сп а д а е т с я н а ато м |
в о дород а и э л ек т р о н , |
||||||
ко т о ры й з а ни м а ет сво ю ваканси ю |
в |
р е ш е т к е |
кристалл а . |
||||
В р е зул ь т а т е об р а зовалас ь молекул а в о дород а и молекул а алке н а . Повер х ност ь м е тал л а вернулас ь в исхо дн о е со сто я ни е .
