
- •Влияние кинетики химических реакций на выбор технологического режима
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Реактор идеального смешения
- •Реактор идеального вытеснения
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Концентрационные кривые накопления
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия

Механизм реакции. Лимитирующая стадия
•Гипотезу о механизме неэлементарных реакций выдвигают на основе имеющихся теоретических представлений. Необходимое условие правильного представления этого механизма — при суммировании всех стадий промежуточные частицы и компоненты сокращаются, давая стехиометрическое уравнение реакции.
•Из гипотезы о механизме реакции выводят ее кинетическое уравнение, исходя из положения, что для каждой элементарной стадии верен простой вид кинетического уравнения.

Механизм реакции. Лимитирующая стадия
•При описании кинетики процесса составляют систему дифференциальных уравнений для скоростей превращения ключевых веществ, для чего записывают скорости их превращения через скорости элементарных реакций

Механизм реакции. Лимитирующая стадия
Например, для двухстадийной необратимой реакции
которая протекает по механизму
где k-1, k1, k2 – константы скоростей реакций;
1) и 2) — две независимые реакции;
А (или С) и L — два ключевых вещества.

Механизм реакции. Лимитирующая стадия
•Для этих независимых элементарных реакций существуют следующие уравнения скорости:

Механизм реакции. Лимитирующая стадия
•Система простая, так как имеются всего две независимые реакции и две стадии. Но в обоих уравнениях участвует концентрация CL, которую не всегда просто определить. В действительности в большинстве неэлементарных реакций устанавливается квазистационарный режим. При этом скорость превращения промежуточной частицы (dCL/dτ) практически равна нулю (сколько образовалось, столько израсходовалось), т.е. продолжительность жизни вещества L неизмеримо мала по сравнению с продолжительностью реакции.

Механизм реакции. Лимитирующая стадия
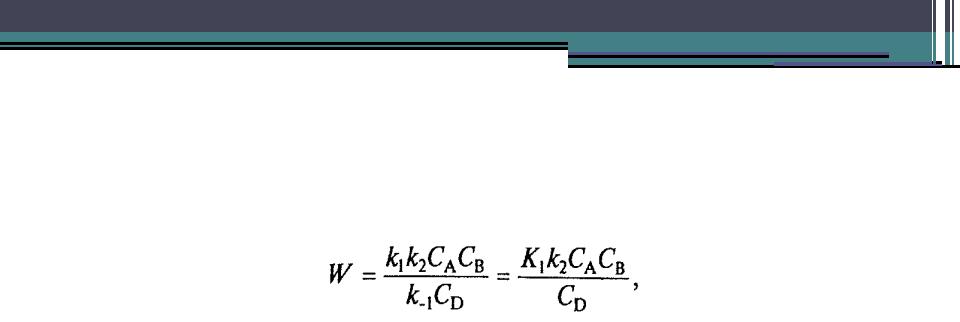
•Пользуясь этим положением, можно найти выражение для CL из и подставить его в кинетическое уравнение реакции:

Механизм реакции. Лимитирующая стадия
•Это уравнение справедливо при сравнимых скоростях реакций обеих стадий. Предположим, что k-1CD<<k2CB, тогда W= k1CA, т.е. скорость реакции определяется скоростью на первой стадии (реакция имеет нулевой порядок по веществу В и таким образом не зависит от концентрации вещества В).
Механизм реакции. Лимитирующая стадия
•Если же k-1CD>>k2CB, то
•т.е. скорость реакции определяется скоростью второй стадии, а в первой быстро устанавливается равновесие. Стадия, скорость которой определяет скорость всей реакции, называется
лимитирующей.

Механизм реакции. Лимитирующая стадия
•Если лимитирующей стадии предшествует быстрая равновесная реакция, то CL можно найти из условий равновесия (метод равновесия):
