
- •Влияние кинетики химических реакций на выбор технологического режима
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Реактор идеального смешения
- •Реактор идеального вытеснения
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Концентрационные кривые накопления
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия

Механизм реакции. Лимитирующая стадия
Получаем концентрационную форму уравнения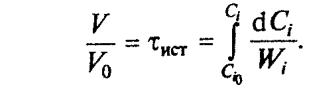
Отношение V/V0 равно истинному времени контакта τист и имеет размерность времени.
Для гетерогенно-каталитических процессов 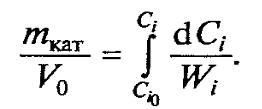 вид
вид

Механизм реакции. Лимитирующая стадия
•В технологии используют временную характеристику – объемную скорость U [объем сырья/объем реактора (катализатора) в час]. Если ее отнести к объему всей поступающей смеси, приведенному к условиям в реакторе, то U= V0/V, т.е. объемная скорость равна объемному потоку на единицу реакционного объема в единицу времени:

Механизм реакции. Лимитирующая стадия
•Для гетерогенно-каталитических процессов объемную скорость относят к единице массы катализатора:
•или к единице объема катализатора:

Механизм реакции. Лимитирующая стадия
•Реакторы идеального вытеснения применяют при изучении реакций в потоке, особенно гетерогенно-каталитических. К условиям идеального вытеснения близки реакторы, представляющие собой трубки большой длины и малого диаметра, а также турбулентное движение потока. Как правило, в реакторе поддерживается постоянная температура, реагенты перед подачей в реактор подогреваются до температуры реакции (в лабораторных условиях используется контактная печь).

Механизм реакции. Лимитирующая стадия
•В условиях непрерывного процесса при каждом опыте получают одну экспериментальную точку, поэтому исследования более длительны и трудоемки, чем в условиях периодического процесса.
•Обработка результатов экспериментов начинается с выдвижения гипотезы о механизме реакций, что позволяет написать их кинетические уравнения и проверить их соответствие результатам эксперимента.

Механизм реакции. Лимитирующая стадия
•Схему превращений выбирают на основе литературных данных, общих положений органической химии или путем постановки специальных кинетических опытов. При составлении схемы превращений учитываются данные об относительных скоростях реакций, термодинамические данные о вероятности протекания реакции в данных условиях, ее обратимости и т.д.
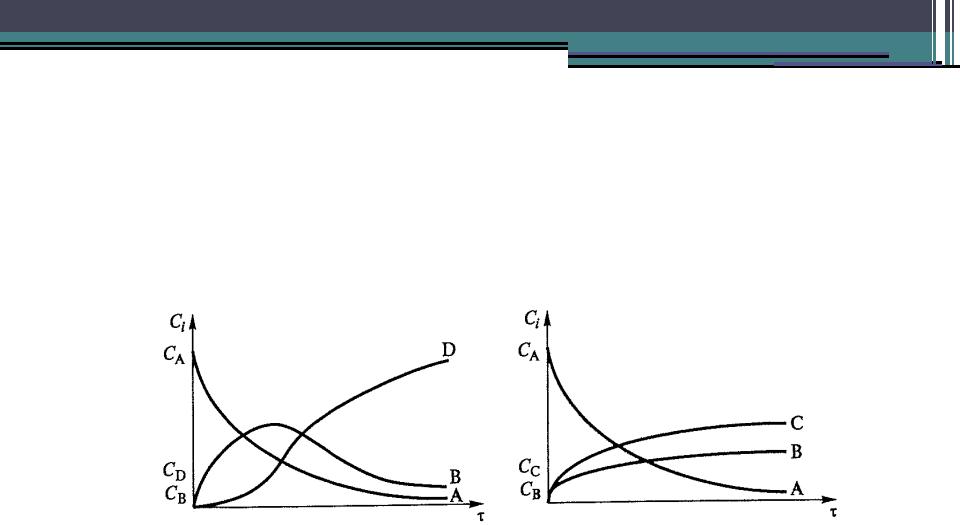
Концентрационные кривые накопления
веществ
Подтверждением принятой гипотезы о схеме превращений может быть вид кинетических кривых
а |
б |
а) в последовательных реакциях А —>В —> D б) в параллельных реакциях А —> В, А —> С
Механизм реакции. Лимитирующая стадия
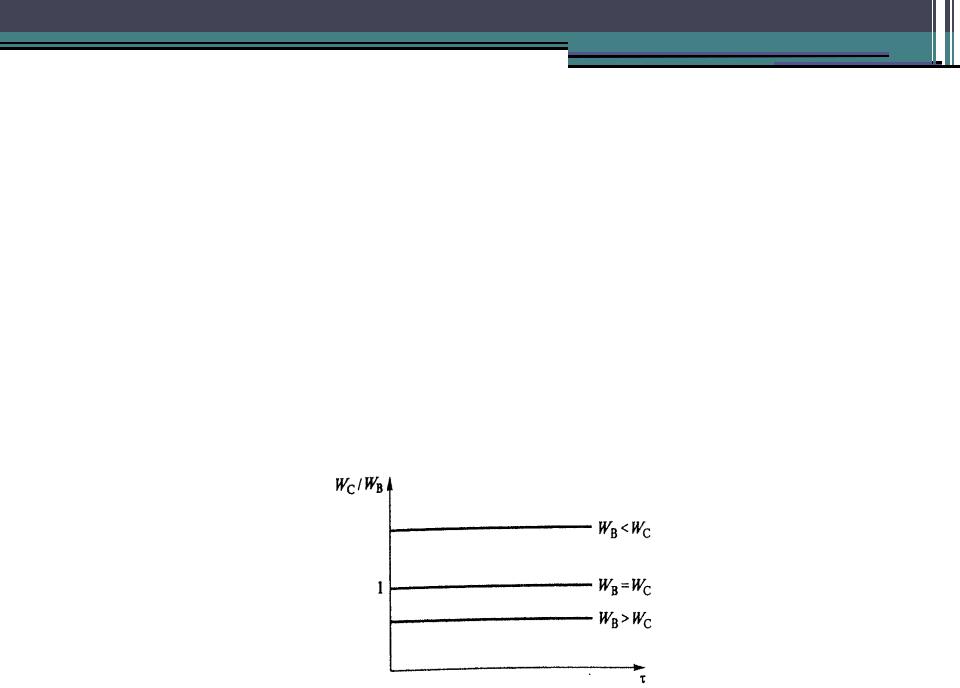
•Судить о возможном механизме протекания реакций можно и по соотношению скоростей накопления отдельных продуктов. Так, при параллельном протекании реакций соотношение WC/WB в нулевой момент
времени величина положительная (не равная 0 или щаяся по ходу протекания
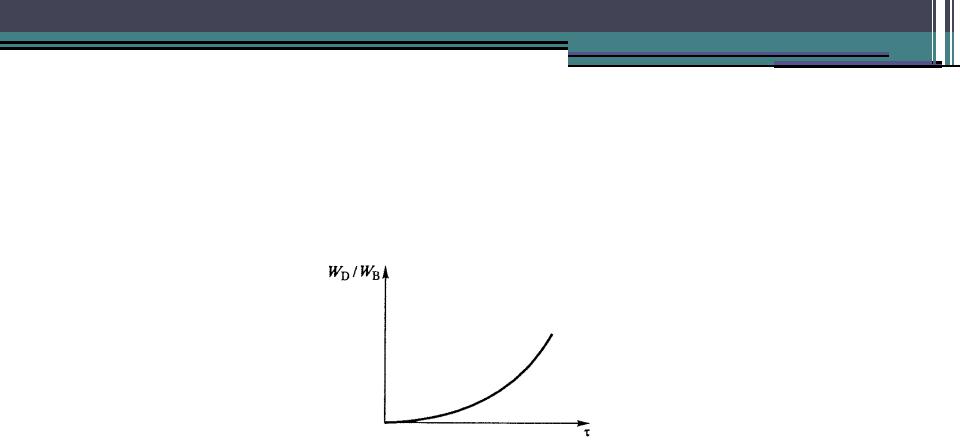
Механизм реакции. Лимитирующая стадия
•В последовательных реакциях соотношение WC/WB в начальный момент времени равно 0 и изменяется во времени
После выдвижения гипотезы о схеме превращений выдвигается гипотеза о механизме и кинетике каждой простой реакции или об их совокупности и построении кинетического уравнения.

Механизм реакции. Лимитирующая стадия
•В химической кинетике с учетом ее механизма принято делить все реакции на элементарные и неэлементарные (сложные).
•Сложные, или неэлементарные, реакции могут состоять только из элементарных реакций.
•В большинстве случаев органические реакции являются неэлементарными, т. е. представляют собой совокупность элементарных стадий, протекающих с образованием промежуточных частиц (радикалов, свободных атомов, ион-радикалов, ионов) или комплексов (с катализатором, растворителями, реагентом и т.д.).
