
- •Влияние кинетики химических реакций на выбор технологического режима
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Реактор идеального смешения
- •Реактор идеального вытеснения
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Концентрационные кривые накопления
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия

Основные понятия химической кинетики
Скорость каждой простой реакции является функцией концентраций веществ, участвующих в этой реакции, и некоторых постоянных:
kj – константы скорости;
Ка – константы равновесия; Ej – энергии активации,
которые называются параметрами химической реакции Ѳj.

Основные понятия химической кинетики
•На реакцию влияют также внешние факторы [Сi(Pi),Т], которые называются параметрами химического процесса, определяющими условия его проведения. Тогда
•Совокупность |
для всех |
ключевых веществ называется |
|
кинетической моделью реакции. Задача кинетических исследований – найти параметры химической реакции и химического процесса для построения кинетической модели.

Механизм реакции. Лимитирующая стадия
•Кинетическое исследование основано на том, что экспериментально определяемые концентрации Сi или конверсии Xi зависят от дифференциальных уравнений скорости
и от параметров процесса. Поэтому необходимо исследовать все параметры, которые могут влиять на скорость: начальные концентрации реагентов, а иногда и продуктов, концентрацию катализатора, температуру, продолжительность реакции.

Механизм реакции. Лимитирующая стадия
•Наиболее сложен вывод концентрационной зависимости
•Обычно проводят серию опытов при постоянной температуре и при постоянных параметрах химической реакции. В этих экспериментах определяют влияние других факторов и вид кинетического уравнения. Затем проводят вторую серию опытов при разной температуре и находят зависимость параметров химической реакции от температуры.

Механизм реакции. Лимитирующая стадия
•Кинетические исследования проводят в аппаратах с идеальным режимом, обеспечивающих наиболее простую связь результатов исследований с варьируемыми параметрами. Такими аппаратами являются реакторы идеального смешения и вытеснения.

Механизм реакции. Лимитирующая стадия
При постоянном объеме скорость реакции описывается уравнением
и после интегриро от τ = 0 до τ при изменении концентрации от Ci0 до
Сi получаем
В периодических условиях определяемым параметром является Сi.
Варьируемые параметры Ci0, T, τ.
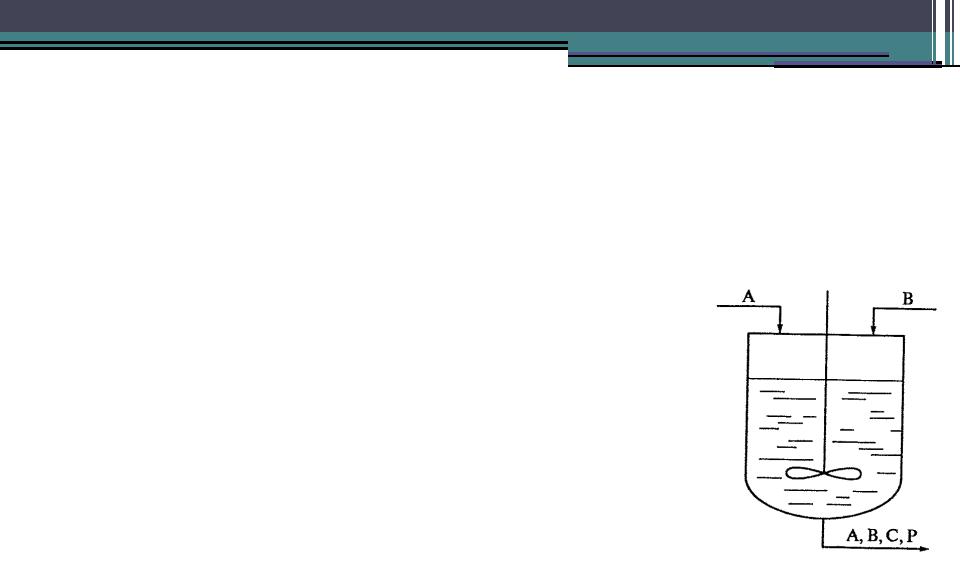
Реактор идеального смешения
•Периодический реактор идеального смешения характеризуется
отсутствием градиента концентраций и температур по объему (dCi/dV=dT/dV=0), что обеспечивается
интенсивным смешиванием. В периодическом реакторе концентрации изменяются только во времени. В реакторах периодического действия идеального смешивания обычно исследуется кинетика жидкофазных (гомо- и ге- терофазных) реакций. В лабораторных условиях таким реактором является колба с эффективной мешалкой
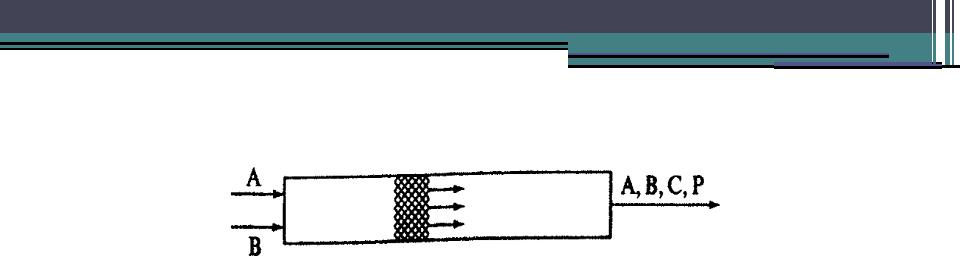
Реактор идеального вытеснения
•При использовании реактора идеального вытеснения реакционная масса перемещается вдоль оси потока, вытесняя предыдущие слои. Все элементы потока движутся вдоль оси с одной и той же линейной скоростью (поршневой режим) при условии отсутствия торможения потока стенками или насадкой.
•Такие реакторы применяют для исследования реакций в потоке, особенно газофазных гетерогенно-каталитических. Концентрация веществ изменяется по длине аппарата.

Механизм реакции. Лимитирующая стадия
•Каждый элемент потока dV находится в реакторе одинаковое время, а концентрация С, и температура Т в каждом поперечном сечении остаются постоянными. Поэтому уравнение материального баланса для молярного потока реактора составляется для бесконечно малого элемента объема, поперечного потоку реагентов:

Механизм реакции. Лимитирующая стадия
•После интегрирования от V=0 до V получаем 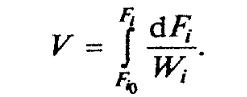
•При постоянном объеме смеси молярный поток
•
•где V0— объемный поток всей реакционной смеси, объем/время.
