
- •Влияние кинетики химических реакций на выбор технологического режима
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Основные понятия химической кинетики
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Реактор идеального смешения
- •Реактор идеального вытеснения
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Концентрационные кривые накопления
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия
- •Механизм реакции. Лимитирующая стадия

Влияние кинетики химических реакций на выбор технологического режима

Основные понятия химической кинетики
•Для решения многих научных, технологических и технико- экономических задач необходимо знать закономерности, определяющие протекание процесса в пространстве и во времени. Эти закономерности находятся экспериментально, а также на основе литературных данных по интересующему процессу.

Основные понятия химической кинетики
•На основании литературных данных и термодинамических расчетов выбирают метод, оптимальный по его себестоимости, доступности сырья, выходу и селективности по целевому продукту.
•Затем проводят экспериментальные исследования, выбирают параметры, исследуют их влияние на выход и селективность, составляют материальный баланс, находят количественные математические зависимости, на основе которых определяются оптимальные условия процесса, проводят моделирование и расчет реакторов.

Основные понятия химической кинетики
Кинетический метод исследования имеет важное значение в двух аспектах
— теоретическом и практическом:
1)теоретический – обоснование механизма реакций и решения вопросов, связанных с реакционной способностью веществ;
2)практический – для расчета и моделирования химических реакторов и оптимизации протекающих в них процессов.

Основные понятия химической кинетики
•Знание механизма реакции необходимо для определения лимитирующей стадии, для установления главных и побочных путей и выбора способа управления процессом для повышения его производительности и селективности. Знание механизма – это важнейший элемент создания интенсивных, высокоселективных и энергосберегающих технологий.

Основные понятия химической кинетики
•Скоростью химической реакции Wi по компоненту i называется изменение его количества, происходящее за единицу времени τ в единице объема V (для гомогенных реакций) или на единице поверхности раздела фаз S (для гетерогенных реакций).
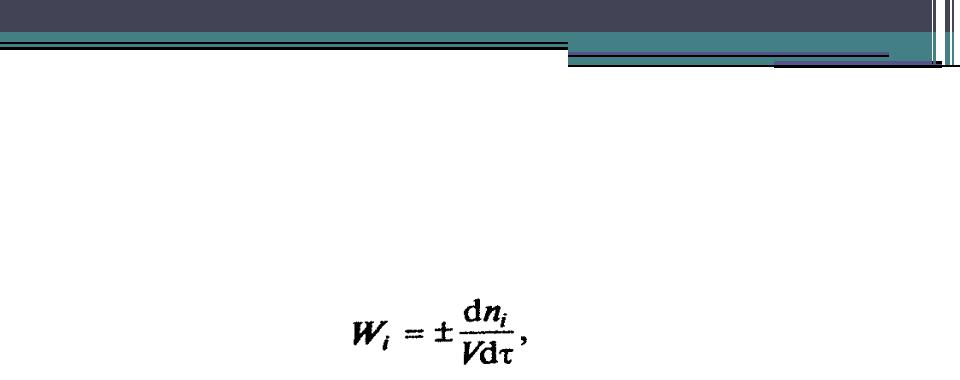
Основные понятия химической кинетики
Скорость гомогенных реакций, моль/объем*время),
где Wi - скорость i-й реакции, моль/(л*с) или кмоль/(м3*ч); ni - количество вещества, моль;
V - объем реагирующей смеси, л или м3;
τ - время (продолжительность реакции), с или ч.

Основные понятия химической кинетики
•Скорость химической реакции может быть определена по любому компоненту, участвующему в реакции; она всегда положительна, поэтому знак (положительный или отрицательный) перед производной dni/dτ должен определяться тем, является ли вещество i исходным реагентом (отношение dni/dτ отрицательное) или продуктом (отношение dni/dτ положительное).

Основные понятия химической кинетики
При V=const=1 л формулу для расчета скорости реакции можно переписать в следующем виде (моль/(объем*время):
где Сi - концентрация вещества i, моль/л, кмоль/м3.
Скорость гетерогенных реакций, моль/м2*время:
где S - площадь поверхности раздела фаз, м2.
Основные понятия химической кинетики
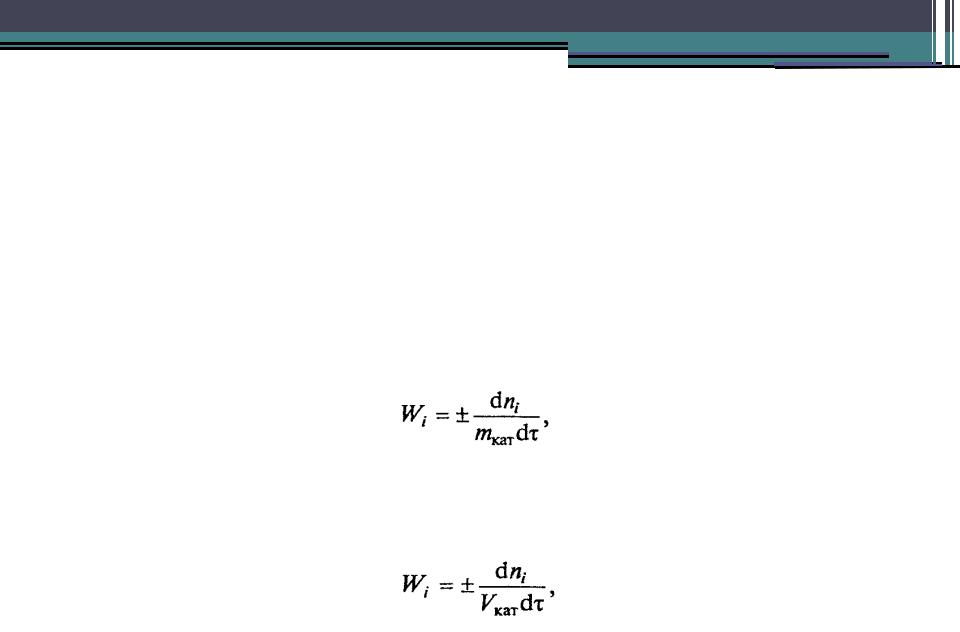
Если площадь поверхности раздела фаз трудно определить, например, в гетерогенно- каталитических реакциях, скорость превращения относят к единице массы или объема катализатора и определяют:
в моль/(масса катализатора-время)
где mкат - масса катализатора, кг;
или в моль /(объем катализатора*время)
где Vкат - объем катализатора, м3.
