
- •Предмет и объекты коллоидной химии
- •Основы термодинамики и поверхностных явлений
- •Правило фаз Гиббса и дисперсность. Влияние кривизны поверхности (дисперсности) на внутреннее давление тел (вывод и анализ уравнения Лапласа). Капиллярные явления (вывод уравнения Жюрена).
- •Адсорбционные равновесия
- •Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основ ныеположения теории Ленгмюра, вывод уравнения и его анализ. Линейная форма уравнения Ленгмюра.
- •Теория полимолекулярной адсорбции бэт: исходные положения, вывод уравнения изотермы и его анализ. Линейная форма уравнения бэт. Определение удельной поверхности адсорбентов, катализаторов и др.
- •Потенциальная теория адсорбции Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и аффинность характеристических кривых.
- •Кинетические свойства дисперсных систем
- •Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия со блюдения закона Стокса. Седиментационный анализ, расчет и назначение кривых распределения частиц по размерам.
- •Электрические явления на поверхностях
- •Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи Чепмена.
- •Современная теория строения дэс (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования дэс. Строение мицеллы (формулы дэс). Электрокинетические явления.
- •Агрегативная устойчивость и коагуляция дисперсных систем
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл; методы определения ккм. Факторы, влияющие на ккм ионных и неионных пав.
- •Ньютоновские жидкости, уравнения Ньютона и Пуазейля. Методы измерения вязкости. Уравнение Эйнштейна для вязкости дисперсных систем, условия его применимости.
- •Моделирование реологических свойств тел, модель и уравнение Бингама. Кривые течения и вязкости жидкообразной и твердообразной систем с коагуляционной структурой. Ползучесть, предел текучести.
Электрические явления на поверхностях
Механизмы образования двойного электрического слоя (ДЭС). Соотношения между электрическим потенциалом и поверхностным натяжением (вывод уравнений Липпмана). Электрокапиллярные кривые и определение параметров ДЭС.
Различают три возможных механизма образования двойного электрического слоя:
Двойной электрический слой образуется в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация). Например, с поверхности металла в газовую фазу переходят электроны, создавая электронное облако со стороны газовой фазы.
Образование двойного электрического слоя происходит в результате адсорбции. Двойной электрический слой может образоваться при избирательной адсорбции в межфазном слое ионов электролитов, не входящих в состав веществ, образующих фазы, т. е. в результате адсорбции примесей.
Если вещества, составляющие фазы системы, не способны обмениваться зарядами, то двойной электрический слой может образоваться благодаря ориентированию полярных молекул сопряженных фаз в результате их взаимодействия. Из объединенных первого и второго начал термодинамики, а также полного дифференциала энергии Гиббса выводится первое уравнение Липпмана, связывающее электрический потенциал с поверхностным натяжением:

где
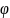 и
и
 – электрический потенциал и избыточный
заряд межфазной поверхности, соответственно.
– электрический потенциал и избыточный
заряд межфазной поверхности, соответственно.
Так как при записи этого уравнения использован метод избытков Гиббса, то все экстенсивные величины в нем являются избыточными. Полный дифференциал избытка внутренней энергии в этом случае равен:
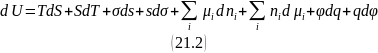
Вычтем из уравнения (21.1) уравнение (21.2):
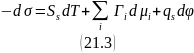
где
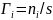 – гиббсовская адсорбция. Нижний индекс
s в этом уравнении указывает на отнесение
к единице поверхности.
– гиббсовская адсорбция. Нижний индекс
s в этом уравнении указывает на отнесение
к единице поверхности.
При условиях
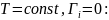
-

Первое уравнение Липмана
Из уравнения следует, что при
самопроизвольном образовании ДЭС
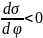 ,
так как в этом случае заряд и потенциал
имеют одинаковый знак, то есть формирование
ДЭС ведет к снижению поверхностного
натяжения, а в точке нулевого заряда
,
так как в этом случае заряд и потенциал
имеют одинаковый знак, то есть формирование
ДЭС ведет к снижению поверхностного
натяжения, а в точке нулевого заряда
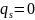 поверхностное натяжение максимально
поверхностное натяжение максимально
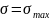 .
.
ДЭС является конденсатором, поэтому емкость ДЭС можно определить как:
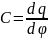
При подстановке этого уравнения в первое уравнение Липмана получим:
-
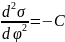
Второе уравнение Липмана
Выразим из этого соотношения заряд
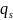 и подставим его в первое уравнение
Липпмана:
и подставим его в первое уравнение
Липпмана:
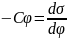

Рисунок
21.1 – Электрокапиллярная кривая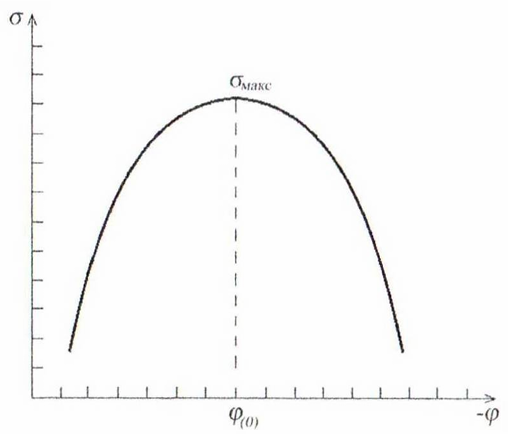 то
уравнение показывает возможность
определения емкости двойного электрического
слоя, если известна зависимость
от
.
то
уравнение показывает возможность
определения емкости двойного электрического
слоя, если известна зависимость
от
.
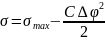
Это уравнение называют уравнением электрокапиллярной кривой. Из него следует, что поверхностное натяжение при условии постоянства емкости двойного электрического слоя изменяется в соответствии с уравнением параболы (рис. 21.1).
Вершина параболы отвечает максимальному
поверхностному натяжению
 .
Парабола симметрична, что по физическому
смыслу означает равное сродство катионов
и анионов, выступающих в роли противоионов,
к поверхности, имеющей соответственно
отрицательный и положительный потенциал.
Уменьшение положительного потенциала,
как и отрицательного, ведет к увеличению
поверхностного натяжения. Однако в
реальных системах емкость двойного
электрического слоя несколько изменяется
с изменением потенциала, и поэтому
экспериментальные электрокапиллярные
кривые обычно не являются симметричными.
Вершина параболы соответствует точке
нулевого заряда. В этой точке поверхностное
натяжение не зависит от потенциала, так
как производная
.
Парабола симметрична, что по физическому
смыслу означает равное сродство катионов
и анионов, выступающих в роли противоионов,
к поверхности, имеющей соответственно
отрицательный и положительный потенциал.
Уменьшение положительного потенциала,
как и отрицательного, ведет к увеличению
поверхностного натяжения. Однако в
реальных системах емкость двойного
электрического слоя несколько изменяется
с изменением потенциала, и поэтому
экспериментальные электрокапиллярные
кривые обычно не являются симметричными.
Вершина параболы соответствует точке
нулевого заряда. В этой точке поверхностное
натяжение не зависит от потенциала, так
как производная равна нулю, т. е. поверхностный слой
имеет нулевой заряд, что означает
отсутствие двойного электрического
слоя. Потенциал же поверхности в этой,
точке не равен нулю.
равна нулю, т. е. поверхностный слой
имеет нулевой заряд, что означает
отсутствие двойного электрического
слоя. Потенциал же поверхности в этой,
точке не равен нулю.
