
- •Предмет и объекты коллоидной химии
- •Основы термодинамики и поверхностных явлений
- •Правило фаз Гиббса и дисперсность. Влияние кривизны поверхности (дисперсности) на внутреннее давление тел (вывод и анализ уравнения Лапласа). Капиллярные явления (вывод уравнения Жюрена).
- •Адсорбционные равновесия
- •Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основ ныеположения теории Ленгмюра, вывод уравнения и его анализ. Линейная форма уравнения Ленгмюра.
- •Теория полимолекулярной адсорбции бэт: исходные положения, вывод уравнения изотермы и его анализ. Линейная форма уравнения бэт. Определение удельной поверхности адсорбентов, катализаторов и др.
- •Потенциальная теория адсорбции Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и аффинность характеристических кривых.
- •Кинетические свойства дисперсных систем
- •Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия со блюдения закона Стокса. Седиментационный анализ, расчет и назначение кривых распределения частиц по размерам.
- •Электрические явления на поверхностях
- •Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи Чепмена.
- •Современная теория строения дэс (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования дэс. Строение мицеллы (формулы дэс). Электрокинетические явления.
- •Агрегативная устойчивость и коагуляция дисперсных систем
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл; методы определения ккм. Факторы, влияющие на ккм ионных и неионных пав.
- •Ньютоновские жидкости, уравнения Ньютона и Пуазейля. Методы измерения вязкости. Уравнение Эйнштейна для вязкости дисперсных систем, условия его применимости.
- •Моделирование реологических свойств тел, модель и уравнение Бингама. Кривые течения и вязкости жидкообразной и твердообразной систем с коагуляционной структурой. Ползучесть, предел текучести.
Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
Для лиофильных дисперсных систем характерно хорошее взаимодействие между дисперсной фазой и дисперсионной средой (большая работа адгезии), что ведет к низкому значению межфазного натяжения и малой поверхностной энергии . Эти системы могут образовываться самопроизвольно за счет либо самопроизвольного диспергирования одной из фаз, либо за счет образования ассоциатов молекул при увеличении их концентрации в растворе (по аналогии с конденсацией). Лиофильные системы являются равновесными и термодинамически устойчивыми. У этих систем нет термодинамических причин для коагуляции.
Примеры: мицеллярные растворы ПАВ и растворы высокомолекулярных веществ (в определенных условиях).
Таблица 26.1 – Классификация ПАВ
По поведению в растворах |
|
Истинно растворимые (до
|
Коллоидные (больше ) |
Образуют гомогенные (истинные) растворы при любых концентрациях вплоть до предела растворимости |
При их определенной концентрации в
растворе образуют гетерогенные
системы, которые относятся к числу
лиофильных термодинамически устойчивых
дисперсных систем (ассоциативные, или
мицеллярные коллоиды), поэтому в
дальнейшем будут рассматриваться
только коллоидные ПАВ. Минимальная
концентрация ПАВ, при которой
осуществляется переход от истинного
раствора к гетерогенной системе за
счет образования мицелл (ассоциатов
молекул ПАВ), называется критической
концентрацией мицеллообразования
(ККМ) и принимает обычно значения
в интервале
|
По способности диссоциировать в растворах |
|
Неионогенные |
Ионогенные |
Не диссоциируют в растворах.
Примеры: оксиэтилированные спирты, кислоты, амины |
Анионные – диссоциируют в водных растворах с образованием поверхностно-активного аниона. Катионные – при диссоциации в воде образуют поверхностно активные катионы. Амфотерные (амфолиты) – в
зависимости от
|
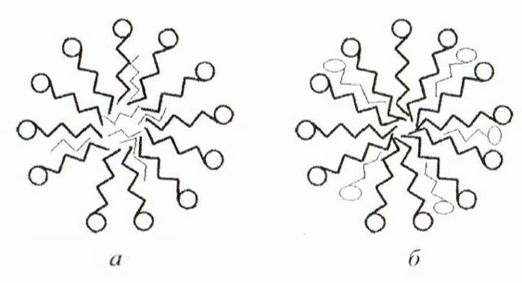
Рисунок
27.1 – Схематическое изображение прямых
(а) и обратных (б) мицелл
 ицеллобразование.
При добавлении коллоидного ПАВ в воду
вначале образуется обычный гомогенный
раствор, но при достижении ККМ наступает
такое состояние, при котором гомогенная
система трансформируется в гетерогенную
за счет образования мицелл, то есть
ассоциатов, состоящих из молекул ПАВ
(или ионов в случае ионного ПАВ).
ицеллобразование.
При добавлении коллоидного ПАВ в воду
вначале образуется обычный гомогенный
раствор, но при достижении ККМ наступает
такое состояние, при котором гомогенная
система трансформируется в гетерогенную
за счет образования мицелл, то есть
ассоциатов, состоящих из молекул ПАВ
(или ионов в случае ионного ПАВ).
Ориентация молекул ПАВ в прямой мицелле
такова, что углеводородные (гидрофобные)
радикалы образуют неполярное ядро
мицеллы («микрокаплю» углеводорода),
находящееся в жидкокристаллическом
состоянии. Полярные группы молекул
(ионов) ПАВ обращены к водной фазе и
экранируют неполярное ядро мицеллы от
полярной дисперсионной среды. Такое
строение мицеллы обеспечивает очень
низкое межфазное натяжение на границе
мицелла – раствор (сотые доли
 )
(рис. 27.1, а). В обратной мицелле
ориентация молекул обратная в виду
сродства углеводородных радикалов к
растворителю (рис. 27.1, б).
)
(рис. 27.1, а). В обратной мицелле
ориентация молекул обратная в виду
сродства углеводородных радикалов к
растворителю (рис. 27.1, б).
Структура мицеллы:
*ПОИ и ПИ находятся в адсорбционном слое
Термодинамика мицеллообразования. Увеличение сродства молекул ПАВ к растворителю (лиофильности) приводит к снижению устойчивости мицелл и увеличению критической концентрации мицеллообразования (ККМ). При повышении степени диссоциации и заряда мицелл увеличивается отталкивание одноименно заряженных ионов.

где – число катионов, входящих в мицеллу; – число молекул ПАВ в мицелле; – константа скорости.
По закону движущих масс:

Активность
мицеллы
 ,
активности катионов (полярной части
ПАВ)
,
активности катионов (полярной части
ПАВ)
 и анионов (радикалов)
и анионов (радикалов)
 ,
тогда получим:
,
тогда получим:

Энергия Гиббса:

На один моль мицеллы:

Тогда энергия Гиббса мицеллообразования:

Для неионогенных ПАВ |
|
|
Полная ассоциация |
|
|
Для неионогенных ПАВ |
|
|
Оба этих фактора ведут к затруднению мицеллобразования.
Самопроизвольное мицеллообразование происходит благодаря дифильному строению молекул ПАВ, которые экранируют углеводородные радикалы, снижая поверхностное натяжение и уменьшая энергию Гиббса системы. Экранирование лиофобных групп также приводит к снижению поглощения теплоты, что уменьшает энтальпию коллоидной системы по сравнению с истинным раствором.
Структура воды играет важную роль, способствуя выталкиванию углеводородных радикалов из раствора, что приводит к разрушению структуры раствора и увеличению его энтропии. По этой причине мицеллообразование можно рассматривать как процесс, приводящий систему в равновесное состояние, то есть связанный с уменьшением энтропии за счет образования межфазной поверхности с меньшей энергией. Мицеллы могут образовываться на межфазной поверхности, если работа адсорбции меньше работы ассоциации молекул ПАВ; в противном случае они разрушаются при выходе на поверхность.
Таким образом, мицеллообразование
протекает самопроизвольно, так как
структурообразование приводит к
увеличению энтропии раствора, возрастающей
при росте концентрации ПАВ из-за удлинения
водородных связей, и снижению поверхностной
энергии за счет экранирования
углеводородных радикалов. В точке
 мицеллы группируются самопроизвольно,
потому что это геометрически более
выгодно, кроме того, большие структуры
увеличивают энтропию раствора.
мицеллы группируются самопроизвольно,
потому что это геометрически более
выгодно, кроме того, большие структуры
увеличивают энтропию раствора.
Солюбилизация – включение в состав мицелл (растворение в мицеллах) веществ, которые не растворяются или плохо растворяются в дисперсионной среде в отсутствие ПАВ в мицеллярной форме. Различают прямую солюбилизацию (в водных мицеллярных системах) и обратную (в углеводородных системах). Солюбилизированное вещество называют солюбилизатом, а ПАВ – солюбилизатором.
Количественно солюбилизирующую способность ПАВ характеризуют величиной относительной (мольной) солюбилизации

где
 – число молей солюбилизированного
вещества;
– число молей солюбилизированного
вещества;
 – число молей ПАВ, находящихся в составе
мицелл.
– число молей ПАВ, находящихся в составе
мицелл.
Рисунок
26.1 – Положение молекул неполярного
(а) и полярного (б) солюбилизаторов в
прямых мицеллах
 рямая
солюбилизация наблюдается при
добавлении к водным растворам ПАВ
неполярных веществ, нерастворимых
в воде, таких как углеводороды,
маслорастворимые красители, жиры. Пример
обратной солюбилизации – растворение
воды в обратных мицеллах, образованных
в углеводородных растворителях. Положение
солюбилизата в мицелле зависит от
строения его молекул. При прямой
солюбилизации неполярные вещества
растворяются в ядре мицеллы (рис. 26.1,
а).
рямая
солюбилизация наблюдается при
добавлении к водным растворам ПАВ
неполярных веществ, нерастворимых
в воде, таких как углеводороды,
маслорастворимые красители, жиры. Пример
обратной солюбилизации – растворение
воды в обратных мицеллах, образованных
в углеводородных растворителях. Положение
солюбилизата в мицелле зависит от
строения его молекул. При прямой
солюбилизации неполярные вещества
растворяются в ядре мицеллы (рис. 26.1,
а).
Молекулы полярных органических веществ типа неспецифических ПАВ (спирты, амины) встраиваются в мицеллу между молекулами основного ПАВ. При этом они сохраняют ту же ориентации, которая есть у молекул ПАВ, образовавших мицеллу (рис. 26.1, б).

 )
)
 раствора они могут проявлять свойства
анионного или катионного ПАВ
раствора они могут проявлять свойства
анионного или катионного ПАВ



