
- •7.2. Изотерма адсорбции. Скорость адсорбции.
- •7.3. Десорбция адсорбентов.
- •Устройство и принцип действия адсорберов
- •7.6. Основные параметры влажного воздуха. Н-х диаграмма влажного воздуха.
- •Определение параметров влажного воздуха по диаграмме н-х.
- •7.9. Схема расчета конвективной сушки
- •7.10. Конструкции сушлок.
- •Кристаллизационное оборудование
- •Мембранные процессы
- •Расчет мембранных процессов.
- •Область применения мембранных процессов.
- •Мембранные аппараты
7 Мембранные процессы химической технологии
7.1. Адсорбция.
Адсорбция – процесс поглощения газов, паров или жидкостей поверхностью твёрдого тела, называемого адсорбентом.
Эффективными адсорбентами обычно являются вещества с высокоразвитой поверхностью. На практике в качестве адсорбентов применяются активированные угли, силикагель, отбеливающие земли, глины. Большое количество мельчайших пор образует значительную внутреннюю поглотительную поверхность адсорбента.
Так, на пример, поглотительная поверхность 1 грамма активированных углей доходит до 1000 м2, а одного грамма отбеливающих глин – до 150 – 450 м2 средний радиус пор – от 2 – 3 до 100 А0.Адсорбенты применяются в виде шариков диаметром от 2 до 6 мм, порошка (20 – 500 мкм).
Адсорбция является одним из эффективных методов разделения газообразных или жидких смесей компонентов, отличающихся по химической структуре. Этот процесс широко распространён в промышленной и лабораторной практике, так как даёт достаточно высокую степень разделения.
С помощью метода адсорбции можно эффективно использовать для аналитических целей при определении количественного состава газообразных и жидких смесей.
Адсорбцию можно применять как для очистки смесей от нежелательных компонентов, так и наоборот, для извлечения из смеси желательных компонентов. Так, при очистке масел в качестве адсорбента используются отбеливающие земли – глины, они служат для удаления смол и некоторых нежелательных веществ (нафтеновых кислот, остатков кислого гудрона, растворителей и т. д.). С другой стороны, на угле адсорбционных газобензиновых заводов активированный уголь служит для улавливания из нефтяных газов газового бензина, который является целевым продуктом.
Адсорбция применяется для определения состава газа, углеводородного состава различных нефтепродуктов в жидком виде, потенциального содержания масел в нефти. Используется в промышленности для отбензинования природных и попутных углеводородных газов, разделения газов нефтепереработки с целью получения водорода, этилена и др. компонентов, для осушки газов и жидкости, выделения низкомолекулярных ароматических углеводородов (бензола, толуола, ксилолов), из соответствующих бензиновых фракций, для очистки парафина и др.
На использовании принципа адсорбции основана работа противогаза (создателем его является Н.Д. Зелинский).
Сравнительно недавно появился новый вид высокоэффективных адсорбентов – цеолиты или так называемые молекулярные сита, представляющие собой алюмосиликаты натрия или кальция с регулирующими размерами пор, сечение которых соизмеримо с размерами молекул. Отличительной особенностью этих адсорбентов является однородность пор по их размерам, поэтому они адсорбируют только те молекулы, которые могут проникнуть в эти поры (адсорбируют н-бутан и не поглощают изобутан).
Молекулярные сита производятся нескольких классов – диаметром пор от 4,5 до 12 А0. Для них характерна высокая адсорбционная ёмкость при повышенных температурах и низких концентрациях извлекаемых компонентов.
Молекулярные сита применяются:
- для разделения смесей газов или жидкостей по размерам молекул (отделение нормальных углеводородов от их изомеров);
- для осушки газов и жидкостей;
- для очистки газов и жидкостей от примесей при низкой их концентрации.
Весьма важной характеристикой адсорбентов является их активность, характеризующая поглотительную способность адсорбента по отношению к различным веществам.
Явление адсорбции, т.е. поглощение вещества поверхностью, объясняется наличием сил притяжения между молекулами адсорбента и молекулами адсорбируемого вещества.
Молекулы адсорбента находящиеся внутри его объёма, не обладают поглощающей способностью, так как силы притяжения между такими молекулами взаимно уравновешиваются.
Различают два вида адсорбции
- физическая;
- хемосорбция.
При физической адсорбции молекулы поглощаемого вещества удерживаются на поверхности абсорбента, не вступая с ними в химическую реакцию.
Связь молекул адсорбата (поглощаемого вещества) с адсорбентом не очень прочная. Процесс этот чаще всего эндотермический.
При хемосорбции молекулы адсорбата химически взаимодействуют с адсорбентом, связь между ними значительно прочнее, чем в первом случае.
Различные вещества по отношению к данному адсорбенту обладают различной способностью адсорбироваться (различной энергией адсорбции), поэтому при вводе в слои адсорбента смеси веществ преимущественно адсорбируются компоненты смеси, обладающие наибольшей адсорбируемостью. Это свойство называется избирательностью и является основой адсорбционного разделения.
Процесс адсорбции прекращается, когда активная поверхность адсорбента будет заполнена слоем молекул адсорбата.
Если в слой адсорбента ввести ввести сравнительно небольшое количество разделяемой смеси, то в этом случае адсорбируются все компоненты. Это происходит до тех пор, пока вся поверхность адсорбента не будет заполнена. Если продолжать подачу исходной смеси, то молекулы с более высокой адсорбируемостью будут вытеснять частично с поверхности адсорбента молекулы вещества с меньшей адсорбируемостью и установиться равновесие между адсорбированной и не адсорбированной средами.
Так, в случае адсорбции газовых компонентов в момент наступления равновесия количество адсорбированного газа определяется следующим выражением:
![]() ; (7.1)
; (7.1)
где М - количество поглощённого адсорбентом компонента (в условиях равновесия);
La - количество адсорбента;
Р - парциальное давление поглощаемого компонента в смеси, находящейся над адсорбентом в момент равновесия;
m и φ - коэффициенты (опред. экспериментально), зависящие от температуры, природы адсорбента и извлекаемого компонента.
Величина α = M/La показывающая количество поглощаемого компонента на единицу количества адсорбента (в условиях равновесия) называется активностью адсорбента по отношению к данному компоненту.
Активность можно измерять в разных единицах (% масс на адсорбент, в граммах на кг. адсорбента и т. д.)
Если исходная смесь проходит через определённый слой адсорбента, то процесс также протекает послойно в направлении движения исходной разделяемой смеси. Адсорбционное разделение в данном слое адсорбента будет завершенно, когда в потоке, выходящем из этого слоя, появиться компонент, подлежащий извлечению из исходной смеси, т.е. когда поверхность адсорбента в соответствии с состоянием равновесия заполниться извлекаемым компонентом и наблюдается «проскок» этого компонента с уходящим потоком.
Количество вещества, адсорбируемого поверхностью, определяется состоянием равновесия и зависит от природы адсорбента и адсорбируемого вещества, концентрации вещества в исходной смеси, температуры процесса и, если адсорбция происходит в газовой фазе, то от давления.
По мере прохождения через слой адсорбента концентрация адсорбируемого вещества уменьшается, поэтому и количество адсорбируемого вещества по высоте слоя также изменяется. Максимальное значение соответствует состоянию равновесия с потоком, отходящим от слоя адсорбента. Изменение количества адсорбируемого вещества происходит на небольшой высоте слоя адсорбента. Если для процесса взят достаточно большой слой адсорбента, то большая часть его окажется полностью отработанной, т.е. насыщенной до состояния равновесия с исходной смесью.
Адсорбируемость вещества зависит от их природы, от структуры и природы адсорбента. Адсорбируемость углеводородов обычно возрастает с увеличением их молекулярного веса. Однако в большей степени она зависит от структуры их молекул (для ароматических углеводородов адсорбируемость возрастает с увеличением числа циклов).
Сернистые соединения имеют такую же и даже более высокую адсорбируемость, чем парафиновые и нафтеновые углеводороды, поэтому их адсорбцией не разделяют. Кислородные, смолистые и азотистые органические соединения имеют повышенную адсорбируемость по сравнению с компонентами углеводородной смеси, поэтому разделение их легко осуществить.
Адсорбируемость высокомолекулярных непредельных углеводородов изучена мало.
7.2. Изотерма адсорбции. Скорость адсорбции.
Адсорбционное равновесие характеризуется определённой зависимостью между концентрацией или парциальным давлением вещества в растворе и на поверхности адсорбента. Количественно адсорбцию принято характеризовать изотермой адсорбции, которая связывает при данной температуре количество адсорбированного единицей веса адсорбента вещества (весовых, молекулярных или объёмных единицах) с составом или парциальным давлением (для газовой среды) разделяемой смеси.

Рисунок 7.1 – Изотермы адсрбции.
С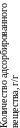 троятся
изотермы на основе экспериментальных
данных. Количество адсорбированного
вещества возрастает с увеличением его
концентрации (или парциального давления)
и с понижением температуры адсорбции
(сам процесс сопровождается выделением
тепла). Наибольшее распространение
имеют следующие уравнения адсорбции
троятся
изотермы на основе экспериментальных
данных. Количество адсорбированного
вещества возрастает с увеличением его
концентрации (или парциального давления)
и с понижением температуры адсорбции
(сам процесс сопровождается выделением
тепла). Наибольшее распространение
имеют следующие уравнения адсорбции
а)Ленгмюра:
![]() ;
(7.2)
;
(7.2)
б) Фрейндлиха:
![]() ; (7.3)
; (7.3)
а – количество адсорбированного вещества на единицу веса адсорбента (его активность)
с - концентрация адсорбируемого вещества (для газовой смеси эту величину заменяют парциальным давлением Р);
к, в, п - константы, зависящие от природы адсорбента, адсорбата и температуры.
Одним из важных показателей, характеризующих процесс адсорбции является скорость адсорбции (от её значения зависят размеры аппарата).
В общем случае скорость адсорбции слагается из следующих скоростей:
- скорости подвода вещества к внешней поверхности зёрен адсорбента внешняя диффузия;
- скорости перемещения вещества внутри зёрен адсорбента по его порам внутренняя диффузия;
- скорость собственно адсорбции, которая протекает мгновенно и поэтому не лимитирует скорость процесса в целом.
=> скорость процесса адсорбции будет лимитироваться только скоростью внешней диффузии, только скоростью внутренней диффузии или зависит одновременно от обеих стадий.
В зависимости от стадии, лимитирующей адсорбцию, скорость подразделяется на внешнедиффузионную, внутреннедиффузионную, смешанную. Внешнедиффузионная скорость зависит от гидродинамического режима (скорости потока), температуры, диаметра зёрен адсорбента, коэффициента диффузии в среде между зёрнами, вязкости и плотности среды. Внутреннедиффузионная скорость процесса определяется сложным явлением внутренней диффузии как в объёме пор, так и на их поверхности. Перемещение молекул в объёме пор зависит от диаметра пор, размера гранулы, размеров адсорбционных молекул, температуры и других факторов.
Наряду с перемещением молекул в объёме пор происходит перемещение их по поверхности адсорбента от одного активного центра к другому (фольмеровская или поверхностная диффузия). (При низкой температуре молекулы вещества адсорбируются на наиболее активных центрах, совершая при этом колебания. С увеличением температуры амплитуда колебаний увеличивается и молекула перескакивает на соседние не занятые центры. Для этого требуется определённая энергия активации, скорость растёт с увеличением температуры).
В общем случае твёрдое вещество имеет поры различной величины и формы, => перенос вещества внутри гранул адсорбента (в объёме пор и на поверхности) может происходить различными путями. Так как явления внешней и внутренней диффузии чрезвычайно сложны, то описать их математически трудно. Часто скорость адсорбции описывается уравнением Ленгмюра:
![]() ,
,
где а - величина (активность) адсорбции в момент τ;
а∞ - величина равновесной адсорбции;
к - константа скорости адсорбции, зависящая от температуры и концентрации адсорбента.
На рисунке представлены кинетические кривые адсорбции бензола из раствора в п-гептане мелкопористым силикогелем. Концентрация бензола составляет 120 ммоль/л раствора. Из рисунка видно, что скорость адсорбции сильно возрастает с повышением температуры от 20 до 40 С из кривых следует, что данная система приближается к равновесию примерно на 95% за 20 минут при 400С; за 35 минут при температуре 300C и за 120 минут при температуре 200С.

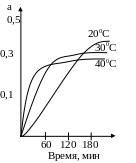

Рисунок 7.2 – Критические кривые адсорбции.
