
Разработка детерминированныхматематических моделей химико-технологических процессов
.pdfМинистерство образования и науки Российской Федерации Государственное образовательное учреждение высшего профессионального образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Филиал ГОУ ВПО УГНТУ в г. Стерлитамаке
КАФЕДРА ОБЩЕЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
РАЗРАБОТКА ДЕТЕРМИНИРОВАННЫХ МАТЕМАТИЧЕСКИХ МОДЕЛЕЙ
ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Учебно-методическое пособие по курсу «Моделирование в химической технологии и расчет реакторов»
Уфа 2011
Учебно-методическое пособие предназначено для студентов специальности 240401 «Химическая технология органических веществ» по курсу «Моделирование в химической технологии и расчет реакторов». В пособии рассмотрены теоретические вопросы, приведены методические указания для проведения лабораторных работ для раздела «Разработка детерминированных математических моделей химико-технологических процессов». Даны рекомендации по выполнению лабораторных работ.
Составители: Пучкова Л.Н., ассистент, канд. техн. наук Быковский Н.А., доц., канд. техн. наук
Фанакова Н.Н., инж. учебного процесса, канд. техн. наук
Рецензент Даминев Р.Р., проф., д-р техн. наук
©Уфимский государственный нефтяной технический университет
|
СОДЕРЖАНИЕ |
|
|
|
с. |
1 |
Правила по технике безопасности. |
4 |
2 |
Общие методические указания по выполнению лабораторных работ. |
4 |
3 |
Лабораторная работа № 1. Моделирование кинетики химической |
|
|
реакции. |
5 |
4 |
Лабораторная работа № 2. Моделирование работы изотермического |
|
|
реактора с гидродинамикой идеального вытеснения. |
14 |
5 |
Лабораторная работа № 3. Математическое моделирование однофаз- |
|
|
ных потоков. |
19 |
6 |
Литература |
26 |
1 ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ ЛАБОРАТОРИИ
Лабораторные стенды и вычислительная техника в лаборатории «Изме- рительно-вычислительный комплекс по моделирования химикотехнологических процессов и лабораторных стендов» питаются от источников электрической энергии с напряжением 220 В, поэтому при проведении работ необходимо строгое соблюдение правил по технике безопасности.
1 Нахождение посторонних лиц (в частности, студентов, свободных от выполнения работ) в лаборатории без ведома преподавателя, проводящего занятия, запрещается.
2 Приступать к выполнению лабораторного практикума можно только после изучения инструкций и инструктажа по технике безопасности на рабочем месте. При этом обязательно оформление контрольного листа по технике безопасности в соответствии с требованиями.
3 Перед началом работы студент обязан осмотреть и привести в порядок рабочее место, проверить правильность подключения ПК в электросеть, проверить исправность токоведущих проводов, вилок, розеток, повреждение изоляции проводов, сколы вилок и розеток не допускаются. Кабель или питающие провода ПК должны в обязательном порядке иметь заземляющий контакт.
4 При работе с ПК студент обязан выполнять ту работу, которая ему поручена руководителем и по которой он был проинструктирован, не загромождать оборудование посторонними предметами, документацией и т.п., которые снижают теплоотдачу.
5 Не оставлять включенный ПК без присмотра. По окончании работы студент должен сообщить об этом преподавателю, выключить ПК привести в порядок рабочее место.
2 ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ
2.1 Порядок выполнения лабораторных работ
Перед началом лабораторной работы студент обязан познакомиться с инструкциями по технике безопасности, прослушать инструктаж по т/б на рабочем месте и расписаться в контрольном листе инструктажа по т/б.
Прежде чем приступить к выполнению лабораторной работы, необходимо изучить ее теоретическую часть, блок-схему и разработать план выполнения лабораторной работы.
После написания программы студент должен показать и ее преподавателю. Полученные данные записывать в соответствующие таблицы. Необходимые вычисления проводить аккуратно с точностью до третьей значащей цифры.
По окончании лабораторной работы показать преподавателю полученные результаты
2.2 Правила оформления отчета
Приступать к оформлению отчета по лабораторной работе следует после выполнения всех экспериментов и необходимых математических расчетов. Отчет оформлять на стандартных листах формата А4 с соответствующими рамками и угловыми штампами согласно ЕСКД. Все рисунки, схемы, элементы электрических цепей, графики должны быть выполнены согласно ЕСКД с помощью чертежных инструментов. При выполнении графиков на осях координат указывать откладываемые величины и единицы их измерения.
На титульном листе отчета должны быть указаны наименование министерства, университета, филиала кафедры и самой лабораторной работы. Затем пишутся фамилия и инициалы студента, выполняющего работу, а также указывается его группа, а ниже – фамилия и инициалы преподавателя, проверяющего работу.
При оформлении лабораторной работы нужно указать все необходимые расчетные формулы. Вычисление проводятся до третьей значащей цифры. В конце отчета необходимо указать список используемой литературы. Для защиты отчета по лабораторной работе необходимо ответить на все контрольные вопросы.
2.3 Содержание отчета
Отчет по лабораторной работе должен содержать титульный лист, цель работы, приборы и принадлежности, химические реактивы, задание на работу, схему лабораторной установки, экспериментальные данные, расчетные формулы, графики, диаграммы и выводы.
3 МОДЕЛИРОВАНИЕ КИНЕТИКИ ХИМИЧЕСКОЙ РЕАКЦИИ
Для математического моделирования любого химического процесса и реактора необходимо знание характера химизма процесса, выявление числа частных реакций в общей структуре химического процесса и численное значение констант скоростей частных реакций k. Все виды реакций можно распределить по трем классам:
- реакции разложения, когда из одного моля вещества образуется несколько молей других веществ с молекулярной массой, меньшей, чем у сырья:
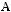



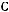

 ; - реакции синтеза, когда из двух разный компонентов сырья образуются
; - реакции синтеза, когда из двух разный компонентов сырья образуются
один или более новых компонентов:

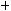

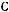

 ;
;

- реакции изомеризации:
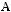

 ,
,
при этом в зависимости от условий проведения процесса реакция может протекать как по прямому, так и по обратному механизму, реакция также может быть равновесной:

 B.
B.
Задачей моделирования химического процесса является определение закона распределения концентраций компонентов реакционной смеси во времени процесса τ, что позволяет определить продолжительность реакции с позиций технологической направленности изучаемого процесса. Эта задача решается путем интегрирования дифференциального уравнения для расчета скорости химической реакции  . Скорость химической реакции по компоненту пропорциональна концентрации исходного компонента реакции j и в общем случае уравнение для расчета скорости химической реакции имеет вид:
. Скорость химической реакции по компоненту пропорциональна концентрации исходного компонента реакции j и в общем случае уравнение для расчета скорости химической реакции имеет вид:






 ,
,
где N – порядок химической реакции.
В тех случаях, когда рассматриваемая реакция является сложной и представляет собой совокупность параллельный и последовательных многокомпонентных реакций, кинетическая модель имеет форму системы дифференциальных уравнений скоростей химических реакций по каждому компоненту реакционной смеси. Если рассматриваемый компонент участвует в нескольких реакциях, то скорость реакции в целом по данному компоненту является суммой скоростей элементарных реакций с участием данного компонента.
Для решения дифференциальных уравнений кинетики химической реакции необходимо принять начальные и конечные условия интегрирования. Начальные условия при времени реакции τ=0 обычно соответствуют начальным заданным концентрациям сырьевых компонентов, а начальные концентрации продуктов реакции приравнивают нулю. Следует учитывать, что если в ходе моделирования кинетики химического процесса выяснится, что продукты реакции необходимо направлять в систему разделения (блоки ректификационных, экстракционных или адсорбционных колонн) для достижения необходимой чистоты целевого продукта процесса, то не прореагировавшие компоненты исходного сырья после их выделения из реакционной смеси возвращаются в реактор (рециркуляционный процесс) с некоторым содержанием продуктов реакции и тогда при повторном моделировании кинетики химического процесса начальные концентрации продуктов реакции станут ненулевыми. Очень важен правильный выбор конечных условий интегрирования, который ограничивают продолжительность химического процесса. Наиболее характерны три варианта задания конечных условий интегрирования, которые можно проиллюстрировать на кинетики последовательной реакции 



 (рисунок 1):
(рисунок 1):
- целью процесса является получение промежуточного продукта B, тогда условием прекращения процесса можно считать достижение максимальной концентрации компонента В - СBmax;

С
СBmax
∆СС
CА доп
τ
Рисунок 1 – Варианты нахождения конечных условий кинетики химической реакции 


 .
.
-целью процесса является получение конечного продукта реакции С, концентрация которого асимптотически стремится к предельному значению, в этом случае на заключительной стадии процесса скорость реакции очень мала стремится к нулю, что будет приводить к неэффективному использованию объема реактора, и реакцию можно прекратить при достижении такой продолжи-
тельности процесса, при которой дальнейшее изменении концентрации ∆СС незначительным (незначимым) для реализуемого процесса;
-целью процесса является уничтожение сырьевого компонента А, например, при очистке токсичных выбросов с целью охраны окружающей среды с переводом токсичного вещества А в нейтральные вещества В и С; при этом конечное время процесса будет достигаться при снижении концентрации компо-
нента А в продуктах реакции до допустимой величины CА доп.
Численное решение дифференциальных уравнений кинетики химической реакции обычно выполняется методами Рунге-Кутта различных порядков. Наиболее простым по алгоритму решения является метод Эйлера (метод РунгеКутта первого порядка). В этом методе ось времени сканируется с постоянными шагами интегрирования ∆τ и концентрация i-того компонента на шаге N+1рассчитывается по его концентрации на шаге N и значению скорости на шаге N по рекуррентному соотношению

 .
.

Точность решения задачи зависит от величины шага интегрирования по времени ∆τ, поэтому обычно задачу решают несколько раз с последовательно уменьшающимися шагами интегрирования (что приводит к увеличению продолжительности расчета задачи) до приемлемого совпадения результатов расчета для последних двух вариантов решения задачи.
В качестве методики рассмотрим расчет кинетики изотермической хи-
мической реакции 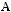




 , где ki – константа скорости частной реакции (рисунок 2). Реакции 1, 2 – первого порядка, 3 – второго порядка. Целевой компонент – В. Известны начальные концентрации Сi0 при времени τ=0 и значения констант ki. Определить продолжительность реакции τр, при котором обеспечивается максимальный выход компонента.
, где ki – константа скорости частной реакции (рисунок 2). Реакции 1, 2 – первого порядка, 3 – второго порядка. Целевой компонент – В. Известны начальные концентрации Сi0 при времени τ=0 и значения констант ki. Определить продолжительность реакции τр, при котором обеспечивается максимальный выход компонента.
Сi
CB max
СC
|
СB |
|
СА |
τр |
τ |
∆τrep |
|
Рисунок 2 – Кинетические кривые реакции 

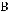

 .
.  - реперные точки, ∆τrep – шаг реперных точек
- реперные точки, ∆τrep – шаг реперных точек
Математическая модель кинетики реакции имеет вид:
И решается по методу Эйлера по рекуррентному соотношению.

 .
.

 ,
,
где ∆τ – шаг интегрирования.
На рисунке 3 приведена блок-схема решения задачи в общем виде, где концентрации компонентов Сi, представленных как А, В, и С для предыдущих (n-x) расчетов и как А1, В1 и С1 для последующих (n+1-x) расчетов. При достижении максимальной величины концентрации В, равной СВ mах, решение задачи прекращается.
Начало
СА0, СВ0, СС0, k1, k2, k3, ∆, τ
τ=0
A=СА0, B=СВ0, C=СС0
A=A1
B=B1
C=C1
τ=τ+∆τ
Да
B1>B
Нет
B, τ
Конец
Рисунок 3- Блок-схема расчета кинетики реакции в наиболее общем виде

Поскольку точность решения задачи по методу Эйлера зависит от величины шага интегрирования (чем меньше шаг, тем точнее решение, но больше продолжительность расчета), рассмотрим принципы автоматического обеспечения правильности расчета, задав погрешность определения концентрации СВ, например с помощью хроматографа, или принять на уровне 1-0,1% от величины
СВ, напрмер ∆СВ=0,001СВ.
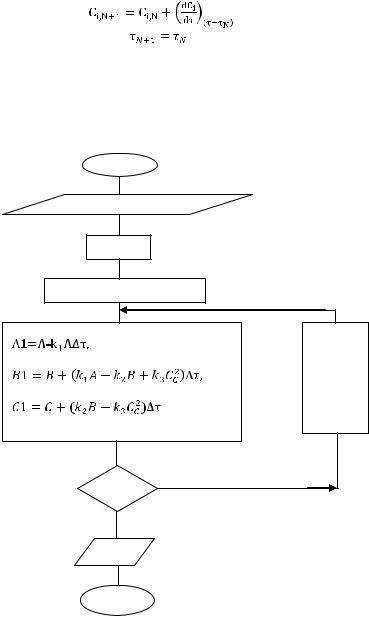
В число исходных данных вводят произвольно малое значение Bmax, например, Bmax=0. После определения лучшей концентрации компонента В в ходе расчета кинетики с шагом ∆τ и сравнения В с Вmax (рисунок 4) расчет полностью повторяют с уменьшенным в 2-10 раз шагом интегрирования (например, ∆τ=∆τ/5) до приемлемого совпадения В и Bmax. Как видно из рисунка 4 получение верного решения достигается дополнением блок-схемы принципиального решения (рисунок 4) всего двумя блоками (8 и 9).
Начало
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
1 СА0, СВ0, СС |
0, k1, k2, k3, ∆, τ |
|||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
τ=0 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A=СА0, B=СВ0, C=СС0 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||
9 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
A=A1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆τ=∆τ/2 |
|
|
|
|
|
|
|
|
|
|
|
|
B=B1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Bmax=В |
|
|
|
|
|
|
|
|
|
|
|
|
C=C1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
τ=τ+∆τ
5 |
B1>B |
Да |
|
|
Нет
Да 8
│В-Вmax│<0.001B
|
Нет |
7 |
B, τ |
|
Конец
Рисунок 4 – Блок-схема расчета кинетики реакции с автоматическим обеспечением правильности расчета
