
- •Лекция 42-2 Производство изопрена
- •1. Теоретические основы синтеза ацеталей. Реакция Принса.
- •2. Технология производства изопрена
- •Технология двухстадийного синтеза изопрена.
- •1, 2 − Реакторы; 3 − нейтрализатор; 4, 5, 6, 7, 8, 9, 13, 14 − ректификационные колонны; 10 − реактор; 11− холодильник; 12 − сепаратор.
- •Одностадийный синтез изопрена.
Лекция 42-2 Производство изопрена
1. Теоретические основы синтеза ацеталей. Реакция Принса.
2. Технология производства изопрена.
1. Теоретические основы синтеза ацеталей. Реакция Принса.
Синтез ацеталей
Полуацетали RCH(OH)OR' и ацетали RCH(OR')2 часто образуются при синтезе альдегидов и их различных превращениях. Они получаются, например, при взаимодействии спиртов с альдегидами, катализируемом НС1, H2SO4 или кислыми солями этих кислот по обратимой реакции, равновесие которой смещается при нагревании в сторону разложения ацеталя:
![]()
Значительно более стабильны циклические ацетали 1,2-гликолей − 1,3-диоксоланы:
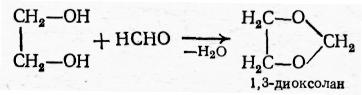
Их производят в промышленном масштабе, так как они являются хорошими растворителями эфиров целлюлозы.
Циклическими ацеталями 1,3-гликолей являются 1,3-диоксаны:
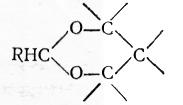
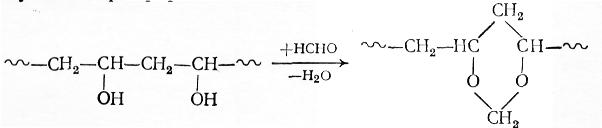
1,3-Диоксановые циклы содержатся в поливинилацеталях, представляющих собой важный класс полимеров − производных поливинилового спирта. Они получаются при обработке поливинилового спирта формальдегидом или к-масляным альдегидом при 60÷80 °С в присутствии фосфорной кислоты
Реакция Принса
Конденсация альдегидов с олефинами, идущая в присутствии катализаторов кислотного типа (реакция Принса), приобрела практическое значение для синтеза ряда веществ. В зависимости от условий проведения реакции получаются главным образом производные 1,3-диоксана или 1,3-гликоли. Кроме того, побочно образуются ненасыщенные одноатомные спирты, насыщенные спирты (продукты гидратации исходных олефинов) и более сложные кислородсодержащие соединения. При повышении температуры может также происходить дегидратация гликоля и ненасыщенного спирта с получением диена. Образование всех этих веществ хорошо объясняет следующая схема:
![]()
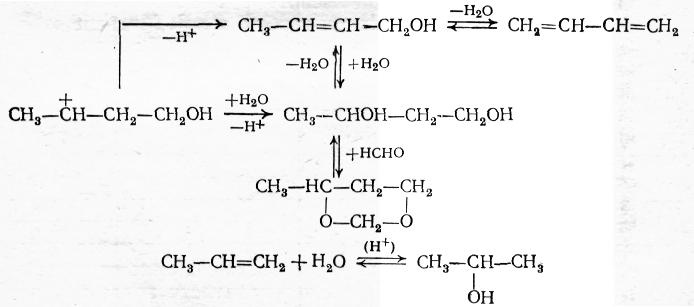
1,3-Диоксаны являются главными продуктами конденсации при умеренных температурах (до 90÷100 °С) и избытке формальдегида по отношению к олефину. Образованию 1,3-гликоля способствуют недостаток формальдегида и повышение температуры. Одновременно усиливается побочное образование ненасыщенных спиртов, а при еще более высокой температуре − диенов.
Реакционная способность олефинов изменяется так же, как в других электрофильных реакциях. Этилен вступает в конденсацию с большим трудом, а легче всего реагирует изобутилен, для которого достаточна температура 25÷40°С при 10÷30%-ной концентрации серной кислоты (катализатор). Однако для интенсификации процесса и экономии кислоты в промышленных условиях поддерживают более высокую температуру (70÷90 °С) и соответственно снижают концентрацию серной кислоты до 1,5%- Для остальных олефинов требуются более жесткие условия (например, для пропилена 100÷115°С и 3÷5%-ная H2SO4). Условия реакции ужесточаются и при переходе от формальдегида к менее реакционноспособному ацетальдегиду и к их высшим гомологам. Кроме серной кислоты предложено использовать и другие катализаторы − соляную, фосфорную и фосфорномолибденовую кислоты, хлористый цинк, фтористый бор и т. д., однако промышленное значение получила только серная кислота.
2. Технология производства изопрена
Получение изопрена
Основное практическое значение реакция Принса нашла для производства изопрена, технология которого была впервые разработана М.И.Фарберовым и М.С.Немцовым. В настоящее время изопрен этим путем получают и в других странах.
Первая стадия состоит в конденсации изобутилена с формальдегидом в присутствии серной кислоты в качестве катализатора [1÷1,5% (масс.) по отношению к изо бутилену]. Мольное отношение С4Н8 : НСНО в исходной смеси составляет 0,73: 1, причем в реакционной массе должен всегда находиться свободный формальдегид, чтобы препятствовать полимеризации изобутилена. Последний можно применять в виде чистого изобутилена или в смеси с бутанами; он может содержать н-бутилены, которые менее реакционноспособны и остаются непревращенными. Формальдегид используют в виде 37%-го водного раствора (формалин), который перед входом в реактор разбавляют рециркулятом. Процесс проводят при 85÷95 °С и 1,5÷2 МПа, когда все реагенты находятся в жидком состоянии. Таким образом, реакционная масса представляет собой жидкую двухфазную систему, и интенсивность реакции во многом зависит от развития поверхности контакта фаз. Реакцию обычно доводят до степени конверсии изобутилена и формальдегида 85÷90%.
Основными продуктами в этих условиях являются 4,4-диметил-1,3-диоксан (селективность 66÷68% по изобутилену и 80÷83% по формальдегиду), трег-бутиловый спирт (выход по изобутилену около 15%) и 3-метилбутандиол-1,3 (5÷7,5%). Кроме того, получаются изомерные ненасыщенные спирты и 5-метилдигидропиран-5,6, образующийся путем замыкания цикла. За счет наличия в формалине метанола последний также находится в реакционной массе и частично дает с формальдегидом метилаль:
![]()
Вторая стадия состоит в каталитическом гидролизе и дегидратации 4,4-диметилдиоксана-1,3 в изопрен. Одновременно протекает побочная реакция его разложения на изобутилен и формальдегид, обратная синтезу диоксана:
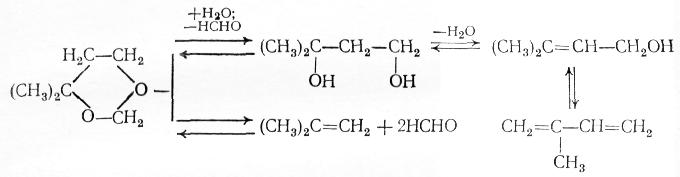
К превращению в изопрен способны и другие продукты первой стадии − ненасыщенные спирты и диол, которые целесообразно направлять на дегидратацию вместе с диоксаном, чтобы повысить суммарный выход изопрена.
Для второй стадии процесса предложены разные гетерогенные катализаторы кислотного типа (фосфорная кислота на носителях, фосфаты, силикагель и др.), причем реакцию осуществляют в газовой фазе при 250÷400°С. Для компенсации эндотермичности реакции разбавляют диоксан перегретым водяным паром, который служит аккумулятором тепла и, кроме того, способствует повышению селективности реакции. Степень конверсии диоксана на этой стадии составляет ≈90% при селективности по изопрену 83÷84% (остальное − главным образом изобутилен, немного метил-масляного альдегида и других высококипящих веществ).
