
Лекции / Лекция 39 Гетерогенно-каталит окисление
.docЛекция 39. Процессы окисления. Гетерогенно-каталитическое окисление
Теоретические основы гетерогенно-каталитического окисления углеводородов: катализ, механизм и кинетика реакций окисления; закономерности гетерогенно-каталитического окисления углеводородов;
Технология гетерогенно-каталитического окисления углеводородов: реакционный узел; технология получения этиленоксила.
Гетерогенно–каталитическое окисление углеводородов и их кислородосодержащих производных приобрело большое значение для промышленной реализации ряда технологий процессов, которые трудно протекают по радикально–цепному пути окисления. Среди них важнейшими являются следующие:
прямой синтез этиленоксила:
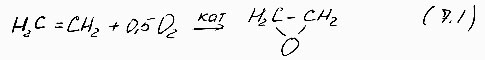
Окисление олефинов по насыщенному атому углерода ( при сохранности двойной связи):
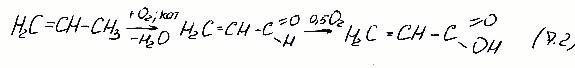
окислительный аммонолиз акролеин алифатических углеводородов с целью получения нитрилов:
![]()
4) Окисление ароматических и алифатических углеводородов с целью получения внутренних ангидридов ди- или тетракарбоновых кислот:
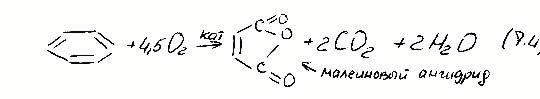
Теоретические основы гетерогенно-каталитического окисления углеводородов
Катализ, механизм и кинетика реакций окисления
Промышленное применение нашли следующие катализаторы:
Cu и Ag. Медь легко окисляется, и каталитические функции выполняет CuO;
Оксиды переходных металлов:
Смеси оксидов и соли переменных металлов, особенно ванадаты, станнаты, вольфраматы, и молибдаты цинка, кобальта, висмута: ZnO·V2O5; СoO·Wо3; Bi2О3·MoO3.
Перечисленные катализаторы применяют в виде стружек или сеток (Сu), зёрен (V2O5) или нанесенными на пористые носители (Ag, CuO, соли) нередко с добавками различных промоторов.
В зависимости от типа катализатора начальная стадия работы катализатора следущая:
Сорбция О2 на металлическом катализаторе. На металлах контакта быстро сорбируется кислород с диссоциацией или без молекулы, причем электроны, необходимые для образования связи, поставляются металлом, а адсобированный кислород переходит в состояние хемосрбирующего ион-радикала:
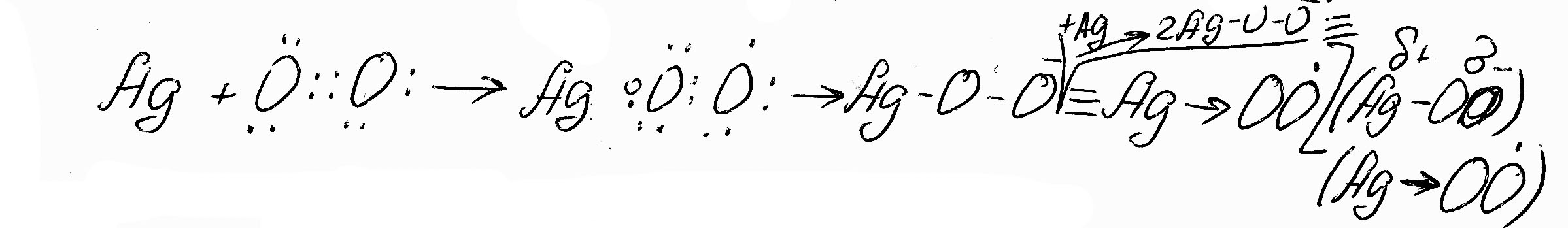 (7.5)
(7.5)
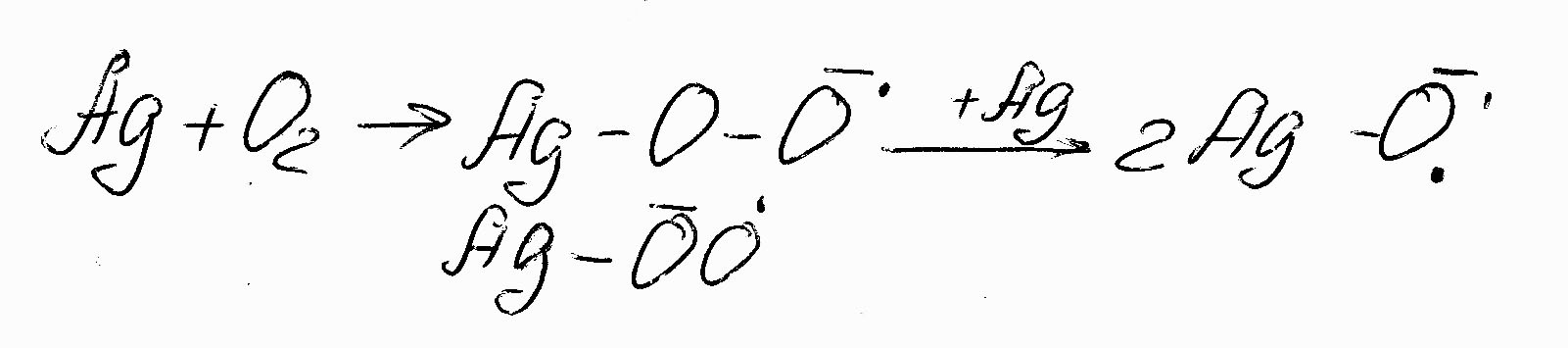
Углеводороды не на металлах сорбируются сравнительно слабо и обратимо, а на оксидных и солевых контактах прочнее. Причём электроны, необходимые для образования связи, поставляются молекулой олефина, которая при этом переходит в состояние хемосорбированного ион радикала:
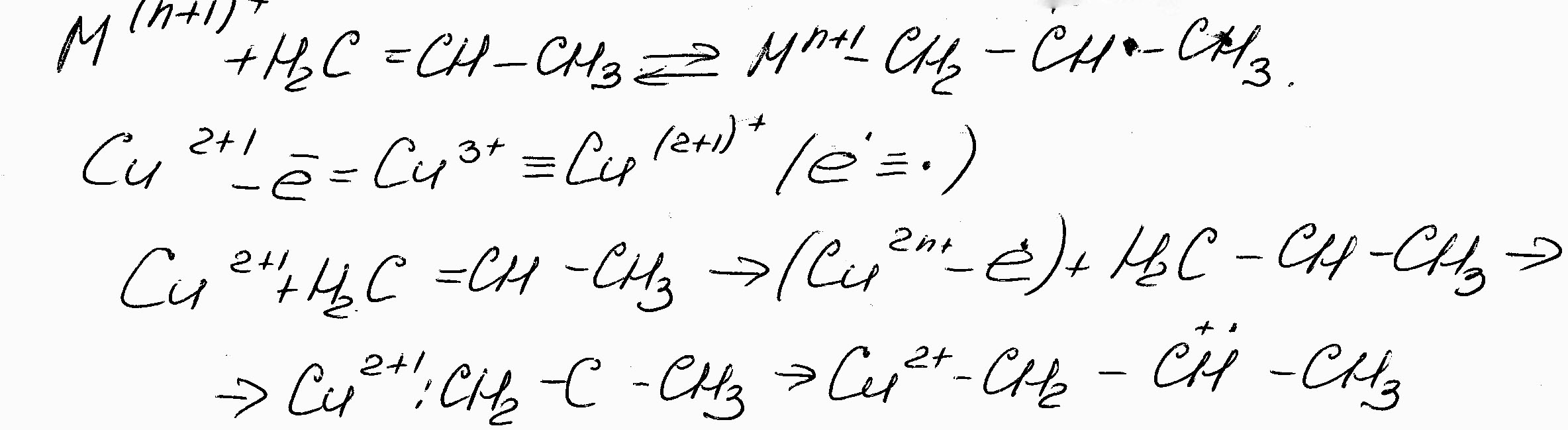 (7.6)
(7.6)
В этой связи считается бесспорным два главных типа механизма гетерогенно–каталитического окисления.
1. В одном из них углеводород на окисленной поверхности катализатора сорбируется вначале по ион-радикалу кислорода, а затем взаимодействует с ним с образованием продуктов окисления:
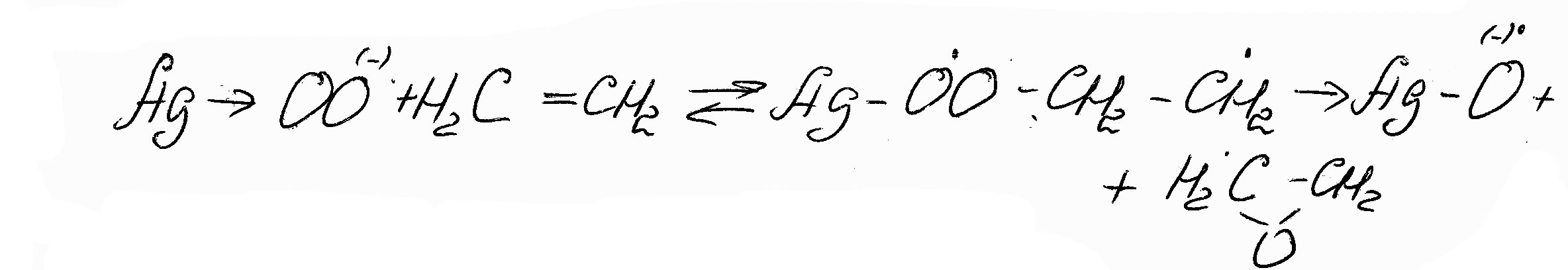 (7.7)
(7.7)
Этот механизм характерен для окисления олефинов по двойной связи.
Например, окисление этилена:
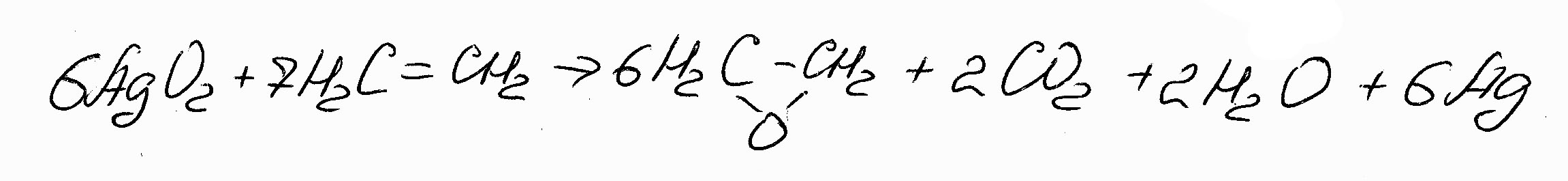 (7.8)
(7.8)
Протекает с 85%-ой селективностью по оксиду этилена (остальные 25%- продукты полного окисления)
2. Другой распространённый механизм гетерогенно–каталитического окисления называют окислительно–восстановительным. Он состоит в восстановлении в низшее валентное состояние металла контакта при окислении сорбированного углеводорода кислородом решётки катализатора и последующем переходе металла в первоначальную степень окисленности при взаимодействии с O2 – окислителем :
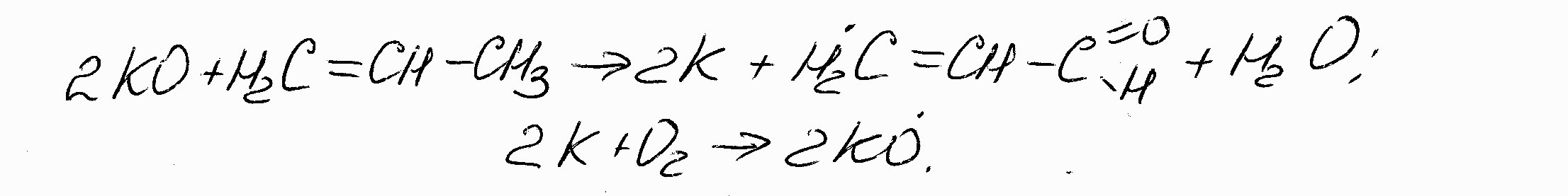 (7.9)
(7.9)
Кинетика.
Установлено, что в кинетической области реакция гетерогенно-каталитического окисления удовлетворительно описывается уравнением Ленгмюра-Хиншельвула:
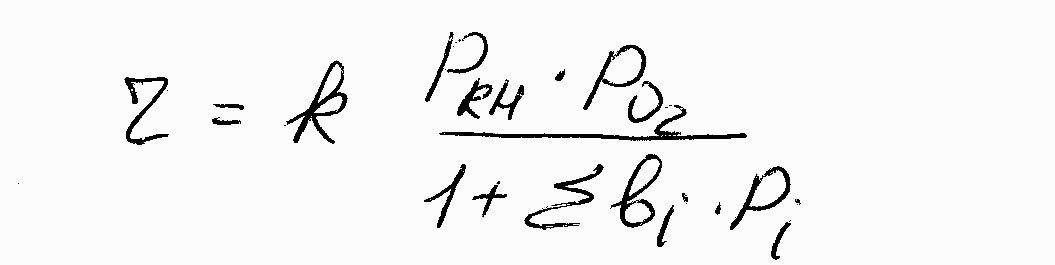 (7.10)
(7.10)
где Pi- парциальное давление, участвующих в реакции углеводорода (RH) и O2.
bi – коэффициент, учитывающий влияние адсорбционных явлений исходных веществ на поверхности контакта.
Уравнение скорости реакции в аппроксимации степенными функциями имеет вид:
![]() , (11)
, (11)
где
![]() и
и
![]() -
кажущийся порядок реакции
-
кажущийся порядок реакции
Порядок реакции по каждому веществу может быть разным, в том числе и дробным, в зависимости от состояния реагентов, окислительно-восстановительных свойств среды, следовательно и от степени окисленности металла и оксида металла в приповерхностном слое.
Например, для окисления этилена и этиленоксил кислородом уравнение скорости реакции следующее:
![]() ,
(12)
,
(12)
где = 0,00…0.45 и =0,55….1.00 и т.д
Приведенные два механизма реакции являются крайними случаями: имеются и промежуточные механизмы, точную картину которых представить пока не удалось.
1.2 Закономерности гетерогенно–каталитического окисления углеводородов: влияние разных факторов на селективность процесса
Окисление олефинов
возможно как по двойной, так и по
насыщенным связям. В первом случае
образуются
![]() -оксиды,
во–втором - продукты окисления по
аллильному углеродному атому.
Закономерности протекания этих реакций
рассмотрим на примере окисления этилена
и пропилена.
-оксиды,
во–втором - продукты окисления по
аллильному углеродному атому.
Закономерности протекания этих реакций
рассмотрим на примере окисления этилена
и пропилена.
В промышленности нашли реализацию как газофазные, так и жидкофазные методы окислительной переработки олефинов. Остановлено, что из гомологов этена в газовой фазе преимущественно образуются продукты окисления по аллильному углеродному атому, а в жидкой фазе - эпоксисоединения. Эпоксодирование даёт положительный результат, как в газовой так и в жидкой фазах, естественно, при окислении этилена.
Обычно при гетерогенно-каталитическом окислении наблюдается следующая схема реакций с параллельным и параллельно-последовательным образованием побочных продуктов полного окисления:
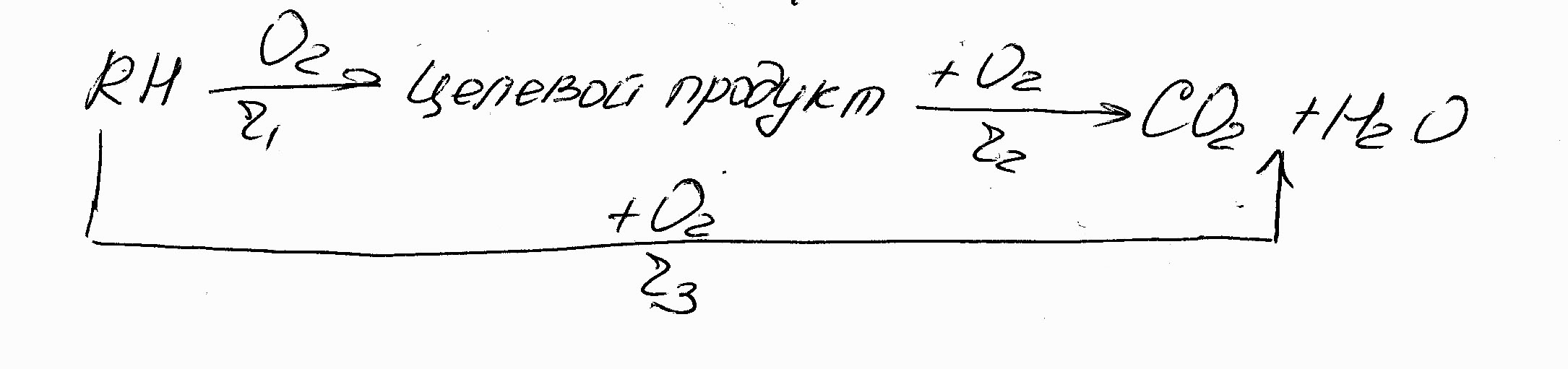 (7.13)
(7.13)
Подавление параллельной реакции полного окисления за счёт варьирования соотношения реагентов обычно невозможно.
Но это возможно:
Регулированием температуры процесса. Энергия активации реакции полного окисления на 21÷24 кДж/моль, чем для целевого процесса и уменьшение температуры приводит к увеличению селективности образования последнего (рис 1-а), т.е. К3/К1 уменьшается.
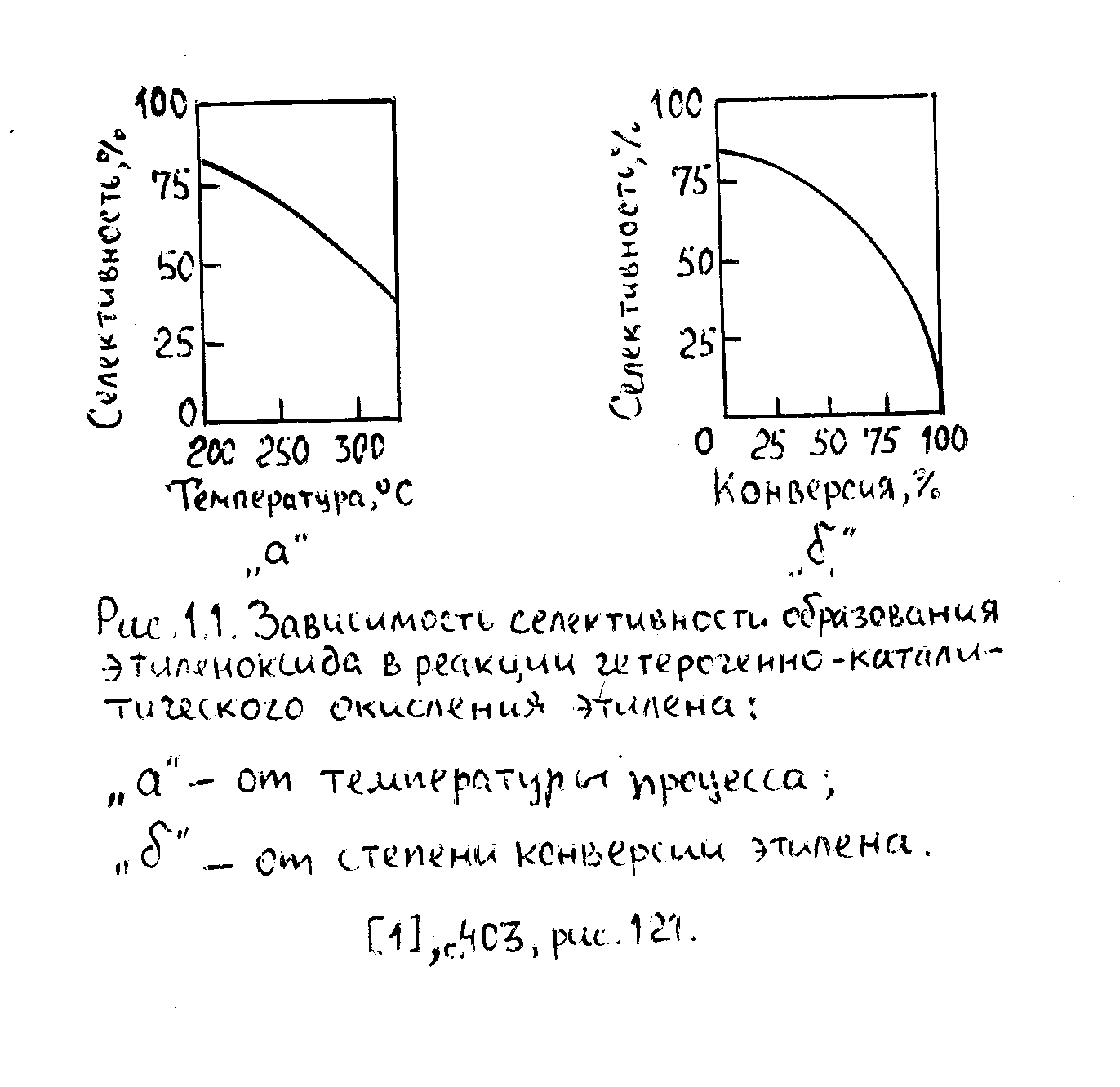
На селективность окисления влияет так же экзотермичность процессов, что обуславливается отсутствием зон перегрева и эффективным теплоотводом.
При всем этом оптимальную область температур определяют с учётом достаточно высокой производительности, а так же экономическими факторами.
Во–вторых, ввиду последовательного окисления целевого вещества в продукты полного окисления, селективность падает с увеличением степени конверсии углеводородов (см.рис. 1-б). С учётом затрат на регенерацию непрореагировавшего углеводорода для каждого конкретного процесса существует своя оптимальная степень конверсии сырья, определяемая экономическими факторами. При прочих равных условиях конверсии углеводорода, а, следовательно и селективность образования целевого продукта регулирует двумя параметрами: временем контакта и количеством подаваемого на реакцию окислителя (чем больше время контакта и количество от стехиометрического окислителя, тем ниже селективность).
Но главным образом на селективность процесса оказывает влияние тип катализатора (состав и способ его приготовления и т.д.) Во–вторых, добавление различных модификаторов или смесей оксидов и солей способно сильно изменить активность и селективность катализатора. Так, некоторые каталитические яды (галогены, селен), дезактивируя серебряный катализатор окисления этилена, существенно повышают его, а так оксиды Bi2O3 и MoO3 в индивидуальном виде способствует полному окислению олефинов, а в форме молибдата висмута (
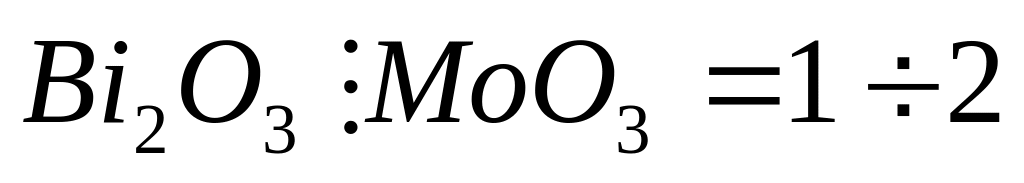 )
является селективным катализатором
окисления пропилена. Большое влияние
оказывает тип носителя, размеры зёрен
катализатора, его пористость и т.д.
Обычно используют катализаторы с
небольшими зёрнами и сравнительно
крупными порами.
)
является селективным катализатором
окисления пропилена. Большое влияние
оказывает тип носителя, размеры зёрен
катализатора, его пористость и т.д.
Обычно используют катализаторы с
небольшими зёрнами и сравнительно
крупными порами.
Выделение гетерогенно-каталитического окисления этилена в качестве примера объясняется двумя причинами:
эпоксилирование этилена протекает более селективно, в сравнении с эпоксилированием его гомологов;
огромной потребностью этиленоксид: мировое производство около 5 млн. т. на сегодняшнее время.
Окисление этилена в зависимости от технологических параметров процесса и типа катализатора может протекать в следующих направлениях:
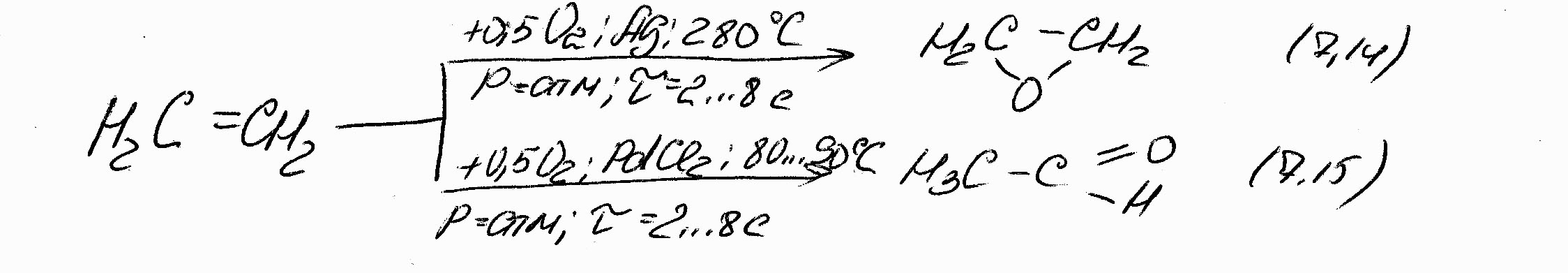
Но решающее влияние на направление реакции окисления оказывает все же тип катализатора. Оказалось, что при использовании катализатора, «Ag на носителе» и Т=200÷3000С образование альдегида практически подавляется. Протекают лишь реакции:
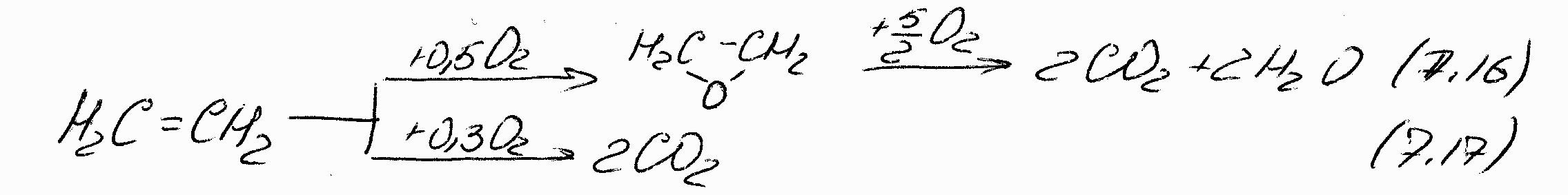
Т.о., факторы и различные параметры, положительно влияющие на селективность образования этиленоксида следующие:
Модификация катализатора (промотирование): серебряный катализатор модифицирует добавками (сурьма, висмут, пероксид бария), повышающее активность и селективность контакта.
Температура. Оптимальная температура 220÷2800С повышение температуры более 2800С приводит к полному окислению этилена. При
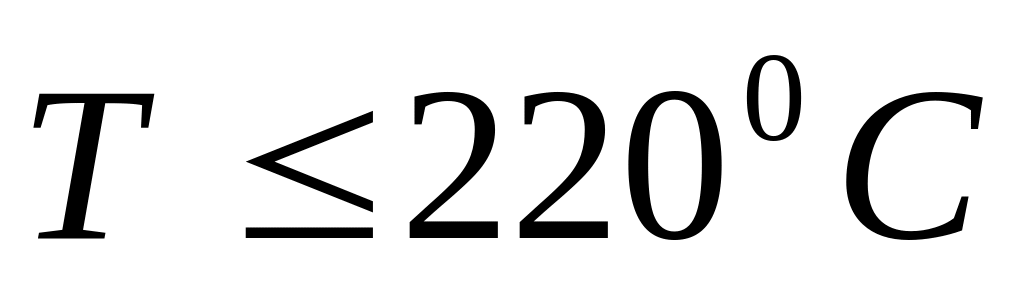 уменьшается производительность
катализатора.
уменьшается производительность
катализатора.Конверсия этилена. При повышении конверсии выше режимного (40÷50 С) селективность значительно падает вследствие более высокой скорости окисления образующего этиленоксида, чем этилена.
Тип реактора. Наиболее подходящим для регулирования степени конверсии сырья, а, следовательно, и селективности образования этиленоксида оказались реакторы, близкие к модели идеального вытеснения, главным образом, трубчатые реакторы.
Реакторы для процессов гетерогенно –каталитического окисления
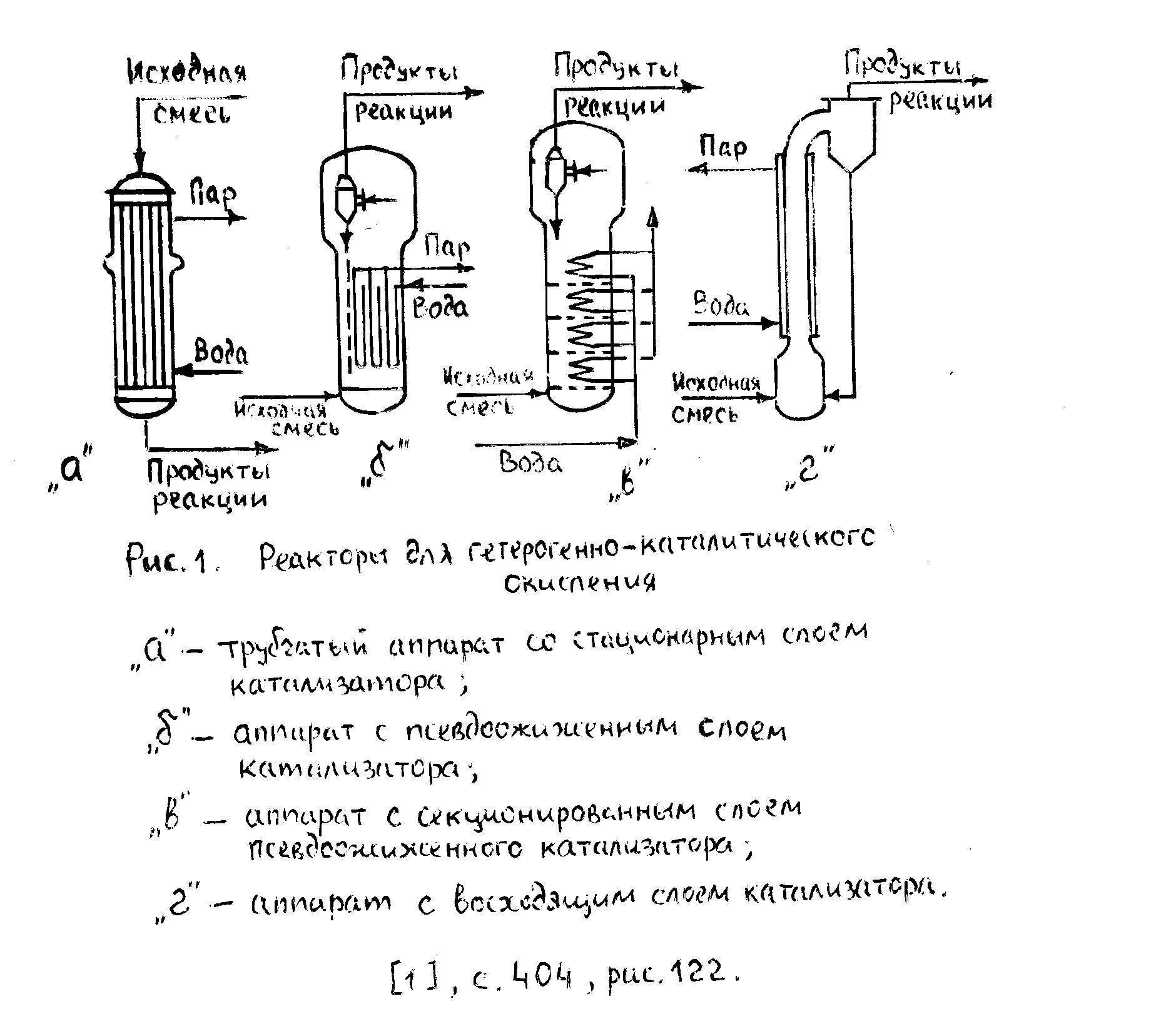
Технология получения этиленоксида (1)
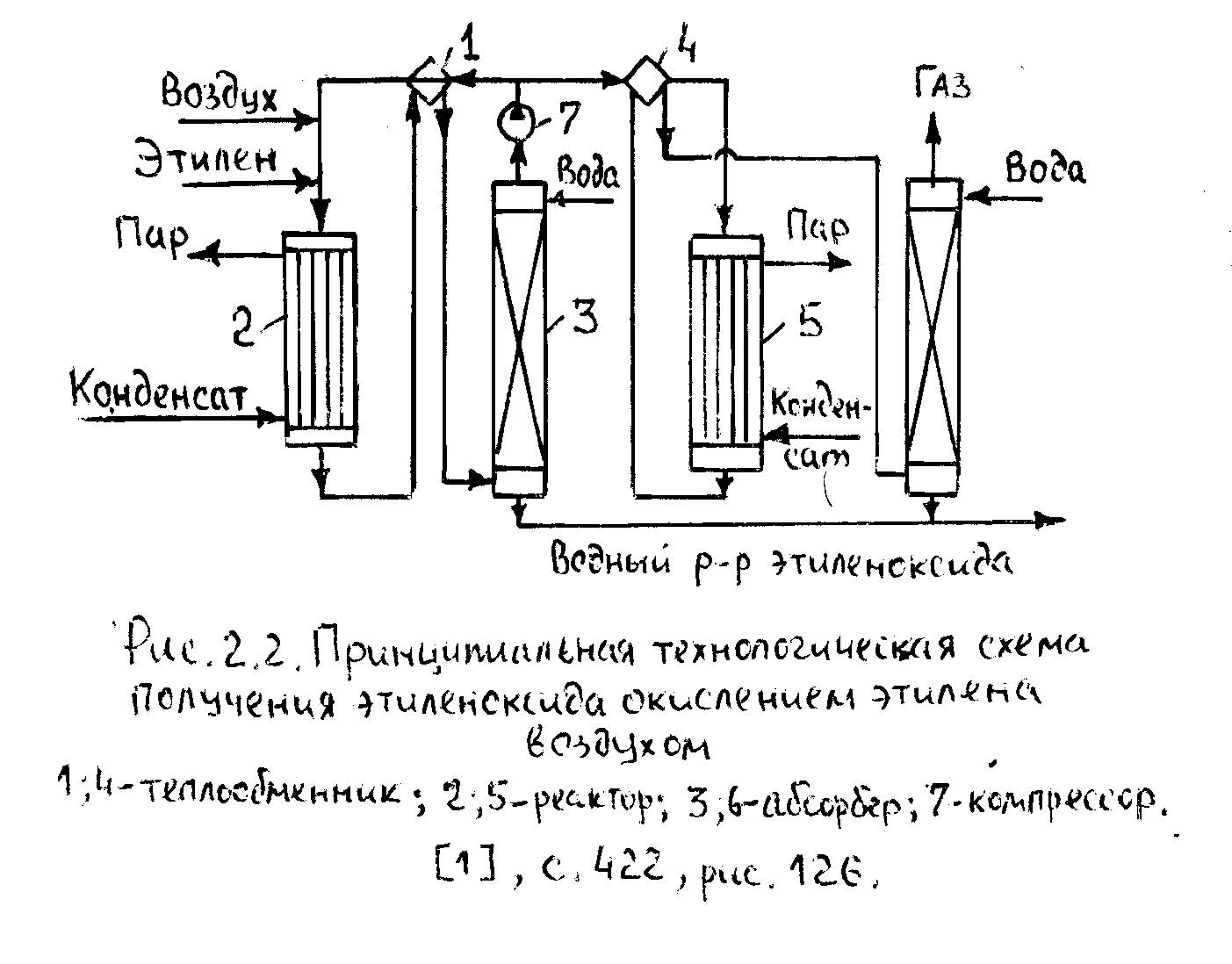
Самостоятельно: окисление этилена воздухом (1), с.421÷422, рис.126.
