
Глава II. Химическая технология органических веществ: химия и технология
Раздел VI. Процессы окисления органических веществ
Реакции окисления протекают обычно в зависимости главным образом от природы реакции окисляемого субстрата по радикально – цепному механизму или гетерогенно – каталитическому пути.
За последнее время получило научное и практическое признание и ускоренно внедряется в производственном масштабе метод окисления олефинов гидропероксидами углеводородами в присутствии металлокомплексных катализаторов.
Таким образом, реакции окисления по механизму протекания можно подразделить на следующие: идущие по радикально – цепному и гетерогенно – каталитическому механизмам и по механизму металлокомплексного катализа.
VI.I. Радикально – цепное окисление органических веществ: теория и технология.
Реакции окисления, протекающие по радикально – цепному пути, характерны для окисления по насыщенному атому углерода и включает три группы процессов:
окисление парафинов;
окисление циклопарафинов;
окисление боковых цепей алкилароматических углеводородов (если таковые имеются).
Целевыми продуктами в этих процессах являются соответствующие гидропероксиды, спирты, кетоны, альдегиды, карбоновые кислоты и их ангидриды, сложные эфиры, а также некоторые полифункциональные соединения этих веществ.
Тема 2. Теоретические и инженерные основы процессов радикально – цепного окисления
Рассмотрим следующие вопросы:
Теоретические основы процессов радикально – цепного окисления парафинов, циклопарафинов и алкилароматических углеводородов по боковой цепи:
Механизм, катализаторы;
Селективность и способы её регулирования.
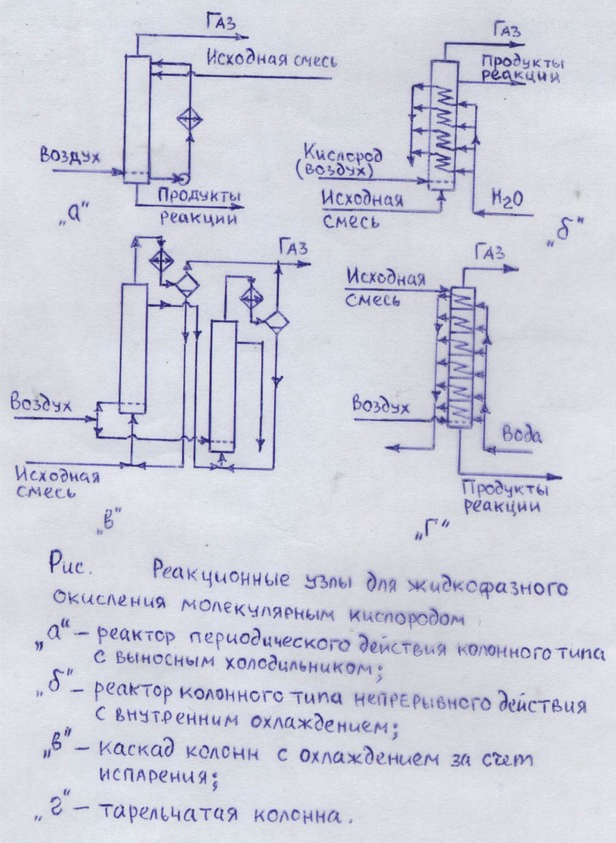
Инженерные основы технологии радикально – цепного окисления [1], с.353, 356, рис. 103
Реакционные узлы;
Технология и технологические схемы.
Реакции радикально – цепного окисления в жидкой фазе в гомогенных условиях осуществляют главным образом двумя способами: термически (автоокисление) и каталитически – в присутствии солей металлов переменной валентности (Со, Mn и др.) и металлокомплексных катализаторов.
Реакции же окисления в газовой фазе инициируются преимущественно термическим путём.
Теоретические основы процессов радикально – цепного окисления парафинов, циклопарафинов и алкилароматических углеводородов
I. I. Механизм, катализаторы
Гомогенное радикально – цепное окисление состоит из стадий зарождения, продолжения, обрыва и вырожденного разветвления цепи.
Зарождение цепи
Первичное образование радикалов, как и во многих радикальных реакциях, происходит при введении инициаторов (гидропероксидов и пероксидов, органических инициаторов: 2,2-азо-бис-изобутиронитрила (порофора) ,пероксида бензола в жидкой фазе; NO, HBr и паров HNO3 в газовой фазе), а также за счёт термического окисления (автоокисления) органического вещества и (или) при взаимодействии кислорода со специальным катализатором, например, по реакциям:
 2ROOH тепло
RO∙ +
ROO∙ + H2O,
(2.1.)
2ROOH тепло
RO∙ +
ROO∙ + H2O,
(2.1.)
 H2O2
hv 2HO∙,
(2.2.)
H2O2
hv 2HO∙,
(2.2.)
N C − C(CH3)2 −N = N − C(CH3)2 − CN t 2NC − C∙(CH3)2 + N2∙, (2.3.)
 RH + O2
температура R∙ +
HOO∙,
(2.4.)
RH + O2
температура R∙ +
HOO∙,
(2.4.)
C o2+ + O2 Со3+ − ОО∙, (2.5.)
Среди других источников радикалов важную роль отводят реакциям вырожденного разветвления цепи: при высокотемпературном окислении в газовой фазе оно достигается окислением, например, реакционноспособных альдегидов:
R − C = O + O2 R − C∙ = O + HOO∙, (2.6.)
\ H
а при умеренной температуре жидкофазных процессов – путём разложения гидропероксидов или пероксикислот:
2 ROOH RO∙ + ROO∙ + H2O, (2.1.)
2 R − COOOH R − COO∙ + R − COOO∙ + H2O∙ (2.7.)
Реакции (2.1.) и (2.7) ускоряются солями металлов переменной валентности (ацетатами и нафтенами кобальта, марганца и др.) – катализаторов жидкофазных процессов окисления:
R OOH + Mn(OAc)2 RO + HOMn (OAc)2; (2.8.)
R − COOOH + Co (OAc)2 R − COO∙ + HOCo(oAc)2. (2.9.)
В этом и состоит традиционное объяснение их каталитического действия в технологиях окисления в жидкой фазе.
Кроме того, образование радикалов может происходить за счет окисления гидропероксидов, альдегидов или даже углеводородов высшей валентной формой катализатора:
R OOH + Mn3+ ROO∙ + Mn2+ + H+; (2.10.)
R H + Co3+ R∙ + Co2+ + H+. (2.11.)
Продолжение цепи
Таким образом, на начальной стадии процесса окисления (зарождение цепи) имеем промежуточные активные частицы – радикалы со свободной валентностью на атоме углерода (R•) или на кислородных атомах (ROO•, R - COOO•, RO•, R - COO•, HO•, HOO•).
В качестве примера более подробно рассмотрим стадию продолжения цепи при синтезе гидропероксидов, спиртов и кетонов.
1. Гидропероксиды
Гидропероксиды – первичные молекулярные продукты окисления углеводородов: RH + O2→ROOH. Звено цепи при их синтезе следующее:
R ∙ + O2 ROO∙; ROO + RH ROOH + R. (2.12.)
Последняя реакция уравнения (2.12.) определяет строение образующегося гидропероксида (и последующих продуктов окисления). При этом соблюдается обычный для радикальных реакций порядок изменения реакционной способности атомов водорода, определяемый относительной стабильностью промежуточного радикала R∙.
трет- > втор- > первич-
100 : 10 : 1
Н2С=СН2−СН2−СН3 + О2 → Н2С=СН−СН−СН3 (2.10.)
׀
ООН
СН3![]()
![]() ׀
׀
−СН−СН3 − СООН
׀ + О2 → ׀
СН3 СН3
Отметим, что из-за нестабильности гидропероксидов в целом их концентрация в реакционной массе невелика и, в особенности, при каталитическом и высокотемпературном окислении. Наиболее нестабильны первичные гидропероксиды: R−CH2−OOH, Ar − CH2 − OOH. Но не все так плохо! Третичные гидропероксиды, из которых гидропероксиды изобутана и изопропилбензола [(СН3)3СООН, С6Н5 − С(СН3)2ООН] производятся даже в промышленном масштабе и являются достаточно стабильными.
2. Спирты и карбонильные соединения
Эти вещества являются вторичными продуктами окисления углеводородов и согласно традиционной схеме Лангебека – Притцкова образуются при разложении гидропероксида по схеме:
Н

 асыщенная
Парафиновый углеводород +О2
разложение
Спирт +О2
асыщенная
Парафиновый углеводород +О2
разложение
Спирт +О2
с вязь
Алкилароматический углеводород
Гидропероксид
(1.13.)
вязь
Алкилароматический углеводород
Гидропероксид
(1.13.)
у/в Олефиновый у/в (С>3) Кетон
разложение
Стадия превращения спиртов по схеме (1.13.) в кетоны также идёт радикально – цепным путём, причем в молекуле спирта атаке подвергается атом углерода, уже затронутый окислением:
+ROO• +O2 +RH
R 2CHOH
R2COH
RCOH R2COH
R2C=O
+ H2O2•
(2.14.)
2CHOH
R2COH
RCOH R2COH
R2C=O
+ H2O2•
(2.14.)
 -ROOH
׀
R-
׀
-ROOH
׀
R-
׀
OO• OOH
При высокотемпературном же окислении в газовой фазе все продукты образуются через пероксидные радикалы, минуя гидропероксиды, причем происходит значительная деструкция по С − С-связи с образованием спиртов и альдегидов:
O
+O2; t-ра +O2 || +C3H8
Н

 3C−СH2−СH2
Н3C−СH2−С∙H2
Н3C−СH2−СH2ОО•
Н−C=O + Н3C−СH
3C−СH2−СH2
Н3C−СH2−С∙H2
Н3C−СH2−СH2ОО•
Н−C=O + Н3C−СH
-НOO• \ H -C3H7
+C3H8
HCHO + H3C−CH2OH + C3•H7; (1.15.)
O
+O2 +O2 +C3H8
Н 3C−СH2−СH3 Н3C−С∙H−СH3 Н3C−СH−СH3 Н3C−С = О + СН3О•
-НOO• ОО• \ H
+C3H8
Н3C−С = О + Н3СОН + С•3Н7. (1.16.)
\ H
В последнее время и при жидкофазном окислении образование продуктов объясняют пероксидным путём. Например, карбонильные соединения могут получать по схеме:
R2CH → R2C• → R2C=O + HO•. (2.16.)
׀ ׀
OO• OOH
При катализе солями металлов переменной валентности также справедлив пероксидный путь синтеза продуктов окисления, но через комплексы соль металла – пероксидный радикал:
R 2CHOO•
+ Co (OAc)2
R2CHOO∙Co(oAc)2∙→
R2C =O
+ HOCo(oAc)2.
(2.17.)
2CHOO•
+ Co (OAc)2
R2CHOO∙Co(oAc)2∙→
R2C =O
+ HOCo(oAc)2.
(2.17.)
Вывод: таким образом, спирты и карбонильные соединения могут получаться при жидкофазном окислении не только последовательно по отношению к гидропероксиду, но и параллельно с ним, а в газофазных процессах – только через пероксидный путь (т.е. не через гидропероксид).
Альдегиды являются наиболее легко окисляемыми соединениями, поэтому при окислении углеводородов в жидкой фазе они либо образуются в небольшом количестве, либо не образуютмя вообще.
Карбоновые кислоты образуются при окислении углеводородов или с сохранением их углеродного скелета, или с деструкцией по С−С-связи. Первое типично только для окисления метильных групп алкилароматических соединений и возможно лишь при превращениях первичных гидропероксидов до альдегидов и наконец до кислот по схеме:
A rCH3 +О2 ArCH2OOH – H2O ArCHO +0,5O2 ArCOOH (1.18.)
При окислении же парафинов и нафтенов карбоновые кислоты образуются с деструкцией углеродного скелета. Наиболее вероятно, что непосредственными предшественниками кислот являются кетоны – они окисляются легче, чем соответствующие углеводороды. Низшие алифатические и ароматические карбоновые кислоты при умеренных условиях стабильны и дальнейшему окислению не подвергаются.
Обрыв цепи
Обрыв цепи при газофазном окислении обычно протекает линейно при столкновении пероксидного радикала со стенкой реактора или с насадкой:
ROO• → ROO адс.,
НOO• → НOO адс. (1.19.)
При жидкофазном окислении происходит квадратичный обрыв на наименее реакционноспособных пероксидных или пероксиацильных (R−C =O−O−OH) радикалах с образованием молекулярных соединений.
Как и в других радикально – цепных процессах, обрыв цепи может происходить на ингибиторах (серосодержащие соединения, фенолы).
Соли металлов в низшем валентном состоянии также могут быть ингибиторами вследствие превращения в их присутствии пероксидных радикалов в анионы, например по реакции:
RCOO∙ + Cu+ → RCOO- + Cu2+ (2.20.)
К актам обрыва цепи относятся также образование продуктов жидкофазного окисления как результата реакции радикалов с ионами металлов катализаторов. Однако при возможности достаточно быстрой регенерации катализатора этот путь становится альтернативным источником получения продуктов окисления:
R2CHOO∙ + Mn2+ → R2C = O + Mn3+ HO- (2.21.)
и роль катализаторов в вырожденном развитии цепи становится менее существенной (см. ур. 2.7' и 2.8').
При этом первоначально введённая соль Co2+ (или Mn2+) в большинстве случаев частично или полностью окисляется (Mn2+→Mn3+ и т.д.), что сопровождается изменением окраски раствора.
