Лекция 36. Процессы окисления органических веществ
Реакции окисления в органической химии, их классификация.
Основные промышленные окислительные агенты.
Энергетическая характеристика реакций окисления.
Актуальные задачи охраны окружающей среды и рационального использования природных и производственных ресурсов.
Процессы окисления органических веществ занимают одно из ведущих мест синтеза разнообразных и ценных химических продуктов. Обусловлено это следующими факторами:
Многообразием окислительных агентов. Обработанностью технико-технологических приемов реализации реакций окисления, которым подвержены практически все классы органических соединении и их различные функциональные производные.
Доступностью и относительно низкой стоимостью используемых в производственных условиях окислителей, что способствует конкурентоспособности синтезируемых продуктов, в сравнении с производимыми альтернативными методами.
Повышенным спросом на промежуточные продукты, растворители, мономеры и другие вещества, получаемые реакциями окисления для производства полимеров, пластификаторов и т.д.
Химическая продукция получаемая в процессе окисления следующая: этиленоксид, терефталевая кислота, фенол, уксусная кислота, акрилонитрил, винилацетат, ацетон, адипиновая кислота и т.д.
Реакций окисления в органической химии и их классификация
Реакциями окисления в органической химии и технологии следует считать превращения веществ под действием окислительных агентов.
Различают полное и неполное окисление органических веществ. При первом происходит окисление веществ с образованием CО2 и Н2О:
![]() (1)
(1)
и для органического синтеза оно является нежелательным (побочным) процессом. Реакции же неполного окисления, на которой собственно и базируется химическая технология окислительных процессов, классифицируют по следующим признакам:
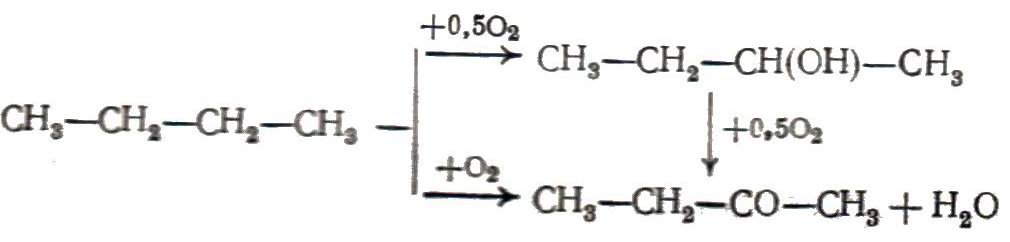
Окисление без разрыва С–С-связи. В этом случае окисление может идти по насыщенному атому углерода нециклических парафинов, олефинов, алкилароматических углеводородов и далее по оксигруппам полученных оксипроизводных этих соединений, особенно спиртов и альдегидов:
|
(2) (3) (4) |
![]() (5)
(5)
![]() (6)
(6)
а также окисление по двойной связи с образованием α-оксидов карбонильных соединений и гликолей:
|
|||||||
|
|
\ / |
|
|
|||
|
|
|
|
|
|||
|
|||||||
|
|| |
|
|||||
|
|
|
|||||
|
|||||||
|
| |
| |
|
||||
|
|
|
|
||||
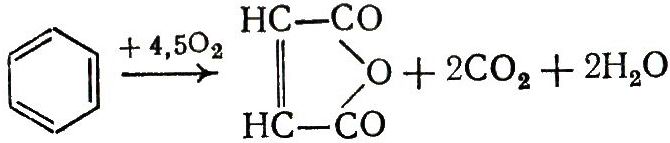
Деструктивное окисление, протекающее с расщеплением С-С, C=C и Сар – Сар – связи:
![]() (10)
(10)
-

(11)
![]() (12)
(12)
|
(13) |
Окислительная конденсация (окислительное сочетание) - окисление, сопровождающаяся связыванием молекул исходных реагирующих веществ:
|
||||||
винилацетат |
|| |
|
||||
|
|
|
||||
|
||||||
|
|| |
|
|| |
|
||
|
|
|
|
диацетат этила |
||
![]() (16)
(16)
![]() (17)
(17)
![]() (18)
(18)
2 Окислительные агенты
В лабораторных условиях и в процессах тонкого, т.е. препаративного органического синтеза используют, главным образом, такие окислительные агенты, как перманганаты (в щелочной, нейтральной или кислотной среде), ди- и триоксиды хрома, пероксиды некоторых металлов (марганца, свинца, натрия). В промышленных же условиях, если это технологически возможно, экономически целесообразно применять более дешевые окислители - кислород воздуха или технический кислород, азотную кислоту, пероксидные соединения типа пероксида водорода, гидропероксиды, пероксикислоты.
Молекулярный кислород (в составе воздуха, технического кислорода или даже азотнокислородных смесей с небольшим содержанием кислорода) является наиболее доступным и дешевым окислительным агентом. Его применяют для проведения, большинства вышеприведенных реакций окисления. Наиболее сильным окисляющим действием обладает концентрированный кислород, но его использование связано, с дополнительными энерго- и материальными затратами на выделение из воздуха. Если все же в каких-то реакциях окисления используют воздух, то уменьшение скорости реакции компенсируют ужесточением режима процесса (например, повышение температуры или общего давления, для повышения парциального давления кислорода).
Азотная кислота и реже оксиды азота являются вторым по масштабам применения окислительным агентом. Обычно в этих целях используют 40÷60 %-ную кислоту, т.к. окисление с более высокой концентрации кислотой сопровождается побочной реакцией нитрования окисляемого субстрата. Для азотной кислоты наиболее типичны реакции деструктивного окисления циклических соединений и веществ с ненасыщенными связями, идущие с лучшими технологическими показателями, чем при окислении кислородом, например:
-

(20)
![]()
![]() (21)
(21)
Экономичность, а также экологическая безопасность производств, использующих в качестве окислителя азотную кислоту во многом зависят от возможности утилизации выделяющихся в ходе реакции оксидов азота (NО2) или (N2O3) и регенерации не превращенной HNO3. Это можно решить окислением оксидов азота воздухом в водном или азотнокислом растворе с получением азотной кислоты:
![]()
![]()
![]() (22)
(22)
Пероксидные соединения главным образом пероксид водорода и перуксусная кислота, а в последнее время и гидропероксиды, начали использоваться в промышленных условиях как окислительные агенты намного позже, чем молекулярный кислород и азотная кислота. В виду относительной дороговизны их используют в тех процессах, которые либо не идут, либо имеют относительно низкие технологические показатели под действием молекулярного кислорода и азотной кислоты.
Наиболее характерное применение пероксидных окислителей.
Пероксид водорода обычно применяют в виде 30 %-ного водного раствора. При окислении им карбоновых кислот получаются соответствующие пероксикислоты по реакции, аналогичной этерификации:
![]() (23)
(23)
Пероксикислоты образуются также при окислении альдегидов, а перуксусную кислоту этим путем получают в промышленном масштабе:
![]() (24)
(24)
Гидроперокаиды главным образом применяют в процессах эпокси-дирования, ненасыщенных углеводородов:
|
||||
|
|
\ / |
|
|
|
|
|
|
|
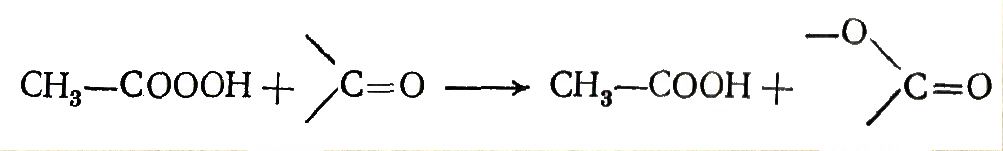
Пероксикислоты более всего пригодны в реакциях окисления, кетонов е получением сложных эфиров или лактонов (реакция Байера- Виллингера).
|
(26) |