
- •Раздел 7 . Химия и технология на основе оксида углерода
- •Теоретические основы процесса оксосинтеза.
- •Принципиальная технологическая схема получения масляных альдегидов и бутанолов. Реакционная аппаратура.
- •Теоретические основы процесса оксосинтеза
- •Принципиальная технологическая схема получения карбоновых кислот. Реакционная аппаратура.
Раздел 7 . Химия и технология на основе оксида углерода
Лекция 35. Процессы оксосинтеза
Теоретические основы процесса оксосинтеза.
Принципиальная технологическая схема получения масляных альдегидов и бутанолов. Реакционная аппаратура.
Теоретические основы процесса оксосинтеза
Реакция оксосинтеза была открыта Рёленом в 1938 г. Целевое назначение реакции – получение альдегидов и продуктов их превращения, главным образом первичных спиртов. Первая промышленная установка была пущена в 1948 г. В настоящее время мощность этих установок во всем мире превышает 4 млн. тонн.
Реакция оксосинтеза
состоит во взаимодействии олефинов с
СО+![]() и получение альдегидов:
и получение альдегидов:
![]() (1)
(1)
Эту реакцию называют также гидроформелированием, вследствие присоединения по двойной связи олефина формильной группы – СНО и водорода. Она необратима и сопровождается значительным выделением тепла, изменяющимся для различных олефинов от 117 до 147 кДж/моль.
Первоначально в реакциях оксосинтеза бал использован катализатор в виде металлического кобальта, затем более эффективные карбонилы кобальта. Эти катализаторы работают при давлениях 10÷30 МПа, снижение давления приводит к их разложению.
В последнее время предложены модифицированные кобальтовые катализаторы, содержащие лиганды триалкилфосфина и гидрокарбонильные комплексы родия, стабильно работающие при давлениях 0,1÷5,0 МПа и 5÷10 МПа соотв.
Механизм и кинетика гидроформелирования наиболее изучены для катализа карбонилами кобальта. Скорость реакции зависит от давления и температуры и эти зависимости имеют сложный характер (см. рис. 1 и 2).
При прочных равных условиях и достаточно низких температурах зависимость скорости гидроформилирования описывается уравнением Аррениуса - линейная зависимость, энергия активации Е для разных олефинов измеряется от 63 до 83 кДж/моль. При дальнейшем повышении температуры скорость растет, но с нарушением линейности и медленно, а затем начинает снижаться с переходом через максимум. Максимум значения скорости достигается при тем более низкой температуре, чем меньше давление.
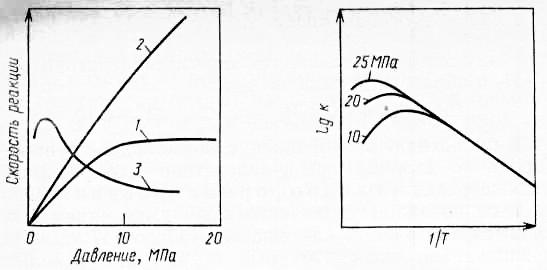
Рис. 1. Зависимость скорости оксосинтеза олефинов от давления при соотношении СО : =1 : 1 1 – от общего давления; 2 – от давления при постоянном парциальном давлении СО, равном 5 МПа. 3 – от давления СО при постоянном парциальном давлении , равном 5 МПа. |
Рис.2. Зависимость скорости оксосинтеза олефинов от температуры при разных давлениях. |
Зависимость скорости реакции от количества катализатора и концентрации (парциального давления) олефина является линейной.
Таким образом, реакция гидроформилирования имеет первые порядки по олефину, водороду и катализатору и сложную зависимость от давления оксида углерода:
![]() (2)
(2)
Реакционная способность олефинов при оксосинтезе изменяется в последовательности:
![]()
причем формильная группа присоединяется к наименее замещенному атому углерода при двойной связи:
![]() (3)
(3)
![]() (4.1)
(4.1)
![]() (4.2)
(4.2)
В реакциях (4.1 и 4.2) выход продукта А больше чем продукта Б. Практическое значение имеют преимущественно н-альдегиды (продукт А) и получаемые из них первичные спирты линейного строения. Увеличению выхода н-альдегидов способствует понижение температуры и общего давления, а также рост парциального давления водорода. Наиболее существенное влияние оказывает природа катализатора: повышению выхода н-альдегидов больше способствуют модифицированные катализаторы, чем традиционные карбонилы кобальта.
Побочные реакции.
Образовавшиеся спирты могут конденсироваться альдегидами в высококипящие ацетали:
![]() (5)
(5)
Реакции альдольной конденсации альдегидов и последующее превращение альдолей с отщеплением воды в ненасыщенные альдегиды:
![]() (6)
(6)
Образование циклических полимеров альдегидов
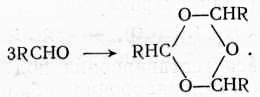 (7)
(7)
При гидроформилировании этилена побочно образуется диэтилкетон, вероятно за счет дальнейшего взаимодействия альдегида с этиленом:
![]() (8)
(8)
Выходу побочных продуктов во всех случаях способствует повышение температуры процесса и это обстоятельство имеет важное значение при выборе оптимальной температуры.
