
- •Лекция 34. Химия и технология на основе оксида углерода
- •Тема 1. Синтезы из оксида углерода и водорода.
- •Теоретические основы синтезов на основе оксида углерода и водорода.
- •Принципиальная технологическая схема получения метанола. Реакционная аппаратура.
- •Теоретические основы синтезов на основе оксида углерода и водорода
- •Принципиальная технологическая схема получения метанола. Реакционная аппаратура.
Лекция 34. Химия и технология на основе оксида углерода
Тема 1. Синтезы из оксида углерода и водорода.
Теоретические основы синтезов на основе оксида углерода и водорода.
Принципиальная технологическая схема получения метанола. Реакционная аппаратура.
Теоретические основы синтезов на основе оксида углерода и водорода
За последние десятилетия органический синтез на основе оксида углерода получил очень большое промышленное развитие. Главное практическое применение получили следующие процессы:
1) синтезы из оксида углерода и водорода (получают алифатических углеводородов и спиртов);
2) процессы оксосинтеза или гидроформилирования олефинов (альдегиды и первичные спирты);
3) синтез карбоновых кислот и их производных (сложных эфиров, ангидридов и др.).
В 20-х годах Фишер и Тропш обнаружили, что в присутствии металлических катализаторов с добавками щелочей или оксидов щелочных металлов из смеси СО и Н2 при давлении до 3 МПа образуются углеводороды:
![]() (1)
(1)
![]() (2)
(2)
При давлении до 10÷15 МПа образуются смесь кислородосодержащих органических соединений.
Получение моторных топлив по Фишеру и Тропшу получили развитие в Германии до 1945 г. Сейчас этот метод практически не используется. Однако, в связи с истощением запасов нефти во многих регионах мира эти процессы возрождаются. Усиленно прорабатывают также так называемый процесс метанирования.
![]() (3)
(3)
для получения бытового газа из угля.
Реакции (1) и (2) при
умеренных условиях необратимы и очень
экзотермичны: ∆Н= 165÷205 кДж на каждую
группу
![]() в получаемом угле водороде. Лучшим
катализатором оказалось железо,
промотированное 0,5%
в получаемом угле водороде. Лучшим
катализатором оказалось железо,
промотированное 0,5%
![]() оно эффективно катализирует процесс
при 220÷320 С и 1,5÷2,5 МПа, т.к. более
теплопроводное и дешевое чем другие..
Имеются два варианта использования
катализатора – в стационарном виде и
в состоянии псевдоожижения. В обоих
случаях предусматривается эффективная
система отвода тепла реакции с охлаждением
кипящим водным конденсатом и генерированием
пара высокого давления.
оно эффективно катализирует процесс
при 220÷320 С и 1,5÷2,5 МПа, т.к. более
теплопроводное и дешевое чем другие..
Имеются два варианта использования
катализатора – в стационарном виде и
в состоянии псевдоожижения. В обоих
случаях предусматривается эффективная
система отвода тепла реакции с охлаждением
кипящим водным конденсатом и генерированием
пара высокого давления.
Получаемые продукты
Парафиновые и
олефиновые углеводороды в основном
линейного строения и с концевым положением
двойной связи в олефинах. Некоторое
количество кислородосодержащих
соединений (спирты и кетоны). По
фракционному составу углеводороды
представляют смесь низших гомологов
(![]() ),
бензина, дизельного топлива, мягкого и
твердого парафина. Групповой и фракционный
состав можно заметно сепарировать,
изменяя температуру, давление и тип
катализатора. Так, синтез можно направить
на преимущественное образование
углеводородов изостроения, обладающих
более высоким октановым числом, линейных
– олефинов и т.д. В последнее время
предложены в качестве катализатора
цеолиты, которые селективны для синтеза
низших олефинов
и
даже ароматических углеводородов.
),
бензина, дизельного топлива, мягкого и
твердого парафина. Групповой и фракционный
состав можно заметно сепарировать,
изменяя температуру, давление и тип
катализатора. Так, синтез можно направить
на преимущественное образование
углеводородов изостроения, обладающих
более высоким октановым числом, линейных
– олефинов и т.д. В последнее время
предложены в качестве катализатора
цеолиты, которые селективны для синтеза
низших олефинов
и
даже ароматических углеводородов.
Принципиальная технологическая схема получения метанола. Реакционная аппаратура.
При давлении до
10÷15 МПа из СО и
![]() получается смесь кислородосодержащих
соединений (синтол) – спиртов, альдегидов,
кетонов, карбоновых кислот и сложных
эфиров. При катализе реакции железом,
промотированными оксидами металлов и
щелочами и температуре 160÷190 С, давлении
20÷30 МПа получаются преимущественно
высшие спирты линейного строения. В
виде примесей получаются различные
изомеры и вторичные спирты. На
промотированном щелочью железном
катализаторе при 400÷475 С и 20÷40 МПа
образуется смесь изобутилового спирта.
Наибольшее практическое значение из
всех этих процессов получил синтез
метанола. Он впервые был осуществлен
Патаром в 1924 г по реакции:
получается смесь кислородосодержащих
соединений (синтол) – спиртов, альдегидов,
кетонов, карбоновых кислот и сложных
эфиров. При катализе реакции железом,
промотированными оксидами металлов и
щелочами и температуре 160÷190 С, давлении
20÷30 МПа получаются преимущественно
высшие спирты линейного строения. В
виде примесей получаются различные
изомеры и вторичные спирты. На
промотированном щелочью железном
катализаторе при 400÷475 С и 20÷40 МПа
образуется смесь изобутилового спирта.
Наибольшее практическое значение из
всех этих процессов получил синтез
метанола. Он впервые был осуществлен
Патаром в 1924 г по реакции:
![]() (4)
(4)
Применением в качестве катализатора ZnO. Затем оксид цинка стали активировать оксидом хрома (на 8 масс. частей ZnO на 1 масс. часть Cr2O3).
В связи с сильной
экзотермичностью процесса константа
равновесия падает с повышением
температуры:
![]() равна
равна
![]() при
300 С и
=
при
300 С и
=![]() при 400 С. Поэтому для роста
приходится повышать давление ввиду
уменьшения объема газовой смеси в
результате реакции. Эти закономерности
иллюстрирует рис.1.
при 400 С. Поэтому для роста
приходится повышать давление ввиду
уменьшения объема газовой смеси в
результате реакции. Эти закономерности
иллюстрирует рис.1.
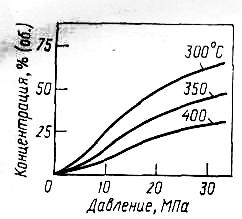
Рис. 1- Зависимость равновесной концентрации метанола в реакционной смеси от давления при разных температурах (СО : Н2 = 1:2)
Механизм образования метанола следующий:
![]() (5)
(5)
Побочно образуется диметиловый эфир – за счет дегидратации метанола; метан – как продукт гидрирования метанола и СО; диоксид углерода – как продукт гидратации СО и вода:
![]()
![]()
![]()
![]()
Получается также
небольшое количество других спиртов,
альдегидов и ацетона; тем не менее
селективность образования
![]() остается достаточно высокой, достигая
95%.
остается достаточно высокой, достигая
95%.
Выбор параметров процесса определяется требованиями высокой селективности и интенсивности процесса, а также его экономической стороной. Температура реакции зависит главным образом от активности катализатора. В свою очередь давление, в зависимости от термодинамической характеристики реакции, должно быть тем больше, чем выше температура, Длительное время процесс проводили при высокой температуре (370÷420 С) и давлении (20÷35 МПа) с оксидным цинк- хромовым катализатором. На этом катализаторе фактическую степень конверсии синтез-газа ограничивают величиной 15÷20%, что достигается при времени контакта 10÷40 с. Попытка снижения давления с целью снижения энергозатрат на сжатие газа и рецикл непрерывного синтез-газа приводила к снижению селективности и производительности процесса.
Сегодня, благодаря
разработке метода тонкой очистки
синтез-газа на основе
![]() и
и
![]() с добавлением промоторов. Это позволило
снизить температуру и давление процесса
соответственно до 250÷300 С и до 5÷10 МПа и
получить дополнительно экономию энергии
на сжатие газа.
с добавлением промоторов. Это позволило
снизить температуру и давление процесса
соответственно до 250÷300 С и до 5÷10 МПа и
получить дополнительно экономию энергии
на сжатие газа.
Технология получения метанола
Реакционный узел синтеза метанола различается в зависимости от способа отвода тепла и проведения реакции.
Значительное распространение получили трубчатые реакторы (см. рис.2.а), в трубах которых находится катализатор и движется реакционная масса, охлаждаемая в межтрубном пространстве водным конденсатом.
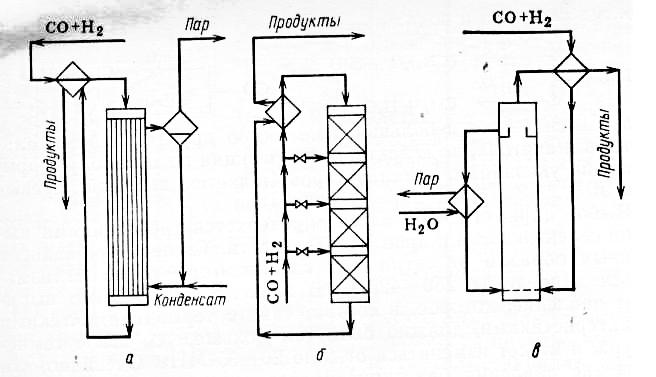
Рис. 2. Реакционные узлы для синтеза метанола.
а – трубчатый реактор; б – адиабатический реактор со сплошным
слоем катализатора; в – реактор для синтеза в жидкой фазе.
Тепло реакционных
газов используется для подогрева
исходной смеси СО и
![]() .
В этом случае достигается наиболее
высокий энергетический КПД и генерируется
около 1 т. пара высокого давления на 1 т.
метанола. Недостатки: высокая металлоемкость
аппарата; малый реакционный объем.
.
В этом случае достигается наиболее
высокий энергетический КПД и генерируется
около 1 т. пара высокого давления на 1 т.
метанола. Недостатки: высокая металлоемкость
аппарата; малый реакционный объем.
Наибольшее распространение получили адиабатические реакторы с несколькими (обычно с четырьмя) слоями катализатора (рис.2б). В них теплообменные устройства отсутствуют, а съем тепла реакции и регулирование температуры осуществляется подачей холодного синтез-газа между слоями катализатора через специальные ромбические распределители, обеспечивающие эффективное смешение горячего и холодного газа. Профиль температуры в таком реакторе ступенчатый, причем его постепенное повышение в слоях катализатора сменяется резким падением при смешении с холодным газом. Часть тепла реакционного газа используется для подогрева сырья, подаваемого на 1-ый каталитический слой, а остальная часть утилизируется с получением пара высокого давления.
В последнее время нашел применение способ названный “синтезом в трехфазной системе”(рис.2в). Процесс осуществляется в жидкой фазе в среде инертного углеводорода с суспендированным в нем гетерогенным катализатором. Тепло реакции отводят за счет циркуляции жидкости через парогенератор или при помощи внутренних теплообменников с кипящим водным конденсатом. Метанол (и часть углеводородов) уносятся с непревращенным синтез-газом; их тепло используется для подогрева исходного сырья. Преимущества метода: степень конверсии СО+ достигает 35% вместо 15%, а концентрация в реакционном газе – 15% (об.) вместо 5 % при обычном синтезе; снижаются рециркуляция газа и энергетические затраты.
Современные
установки получения метанола обычно
комбинируют с производством синтез-газа,
причем очистку СО+
проводят в данном случае абсорбцией
получаемым метанолом. На ряде установок
СО+
не очищают от примесей
![]() - он участвует в образовании
.
При этом оптимальное мольное соотношение:
- он участвует в образовании
.
При этом оптимальное мольное соотношение:
![]() составляет (2,05÷3) : 1.
составляет (2,05÷3) : 1.
Полученный пар высокого давления используют для привода турбокомпрессоров, а мятый пар с турбин расходуют на конверсию углеводородов в синтез-газ и на нужды процессов ректификации.
Технологическая схема синтеза метанола.
Технологическая
схема синтеза метанола изображена на
рис. 3. Очищенный синтез-газ сжимают
турбокомпрессором 1 до 5÷10 МПа и смешивают
с возвратным непрореагировавшим СО+
,
который дожимают до рабочего давления
циркуляционным турбокомпрессором 2.
Смесь проходит адсорбер 3, предназначенный
для очистки газа от пентакарбонила
железа. Это вещество образуется при
взаимодействии с железными частями
аппаратуры и разлагается в реакторе с
образованием мелко дисперсионного
железа, катализирующего нежелательные
реакции образования
![]() и
.
и
.
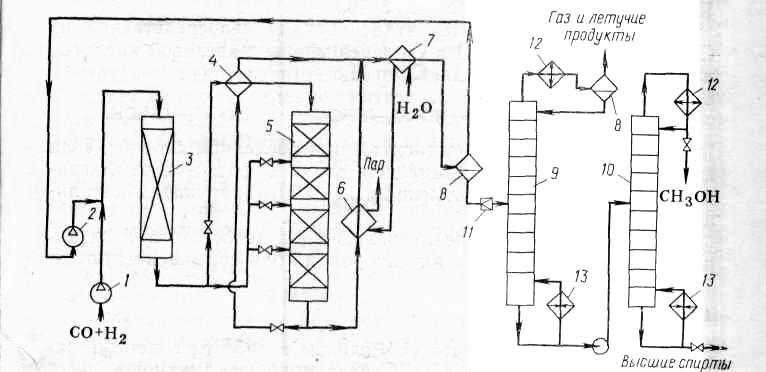
Рис.3. Принципиальная технологическая схема синтеза метанола.
1 – турбокомпрессор; 6 – парогенератор;
2 – циркуляционный трубокомпрессор; 7 – холодильник;
3 – адсорбер; 8 – сепаратор высокого давления;
4 – теплообменник; 9, 10 – ректификационная колонна;
5 – реактор.
По этой причине, а также из-за опасности водородной коррозии реактор выполняют из легированной стали.
Газ после адсорбера разделяют на два потока: один подогревают в теплообменнике 4 и подают в верхнюю часть реактора 5, а другой вводят в реактор 5 между слоями катализатора в холодном виде (для отвода тепла реакции и регулирования её температуры). Реакционный газ на выходе из реактора имеет температуру около 300 С. Он также разделяется на два потока: один проходит теплообменник 4, отдавая тепло смеси СО+ , идущей на реакцию, а другой направляют в парогенератор 6 для получения пара высокого давления. Потоки газа затем объединяют и охлаждают в холодильнике 7, где метанол конденсируется и отделяется от газа в сепараторе 8 высокого давления. Газ возвращают на реакцию.
Конденсат с низа
сепаратора дросселируют до давления,
близкого к атмосферному, и в ректификационной
колонне 9 метанол отделяют от растворенных
газов и летучих продуктов (![]() ),
которые идут на сжатие. В ректификационной
колонне 10 отгоняют метанол от небольшого
количества высших спиртов, которые
также направляют на сжигание. Полученный
товарный метанол имеет степень чистоты
до 99,95% с выходом от теории до 95% с учетом
рецикла.
),
которые идут на сжатие. В ректификационной
колонне 10 отгоняют метанол от небольшого
количества высших спиртов, которые
также направляют на сжигание. Полученный
товарный метанол имеет степень чистоты
до 99,95% с выходом от теории до 95% с учетом
рецикла.
(1)
(2)
Рис. 1- Зависимость равновесной концентрации метанола в реакционной смеси от давления при разных температурах (СО : Н2 = 1:2)
(5)
;
,
Рис. 2. Реакционные узлы для синтеза метанола.
а – трубчатый реактор; б – адиабатический реактор со сплошным
слоем катализатора; в – реактор для синтеза в жидкой фазе.
Рис.3. Принципиальная технологическая схема синтеза метанола.
1 – турбокомпрессор; 6 – парогенератор;
2 – циркуляционный трубокомпрессор; 7 – холодильник;
3 – адсорбер; 8 – сепаратор высокого давления;
4 – теплообменник; 9, 10 – ректификационная колонна;
5 – реактор.
