
Лекции / Лекция 30 Процессы сульфатирования
.doc
Раздел 6 ПРОЦЕССЫ СУЛЬФАТИРОВАНИЯ, СУЛЬФИРОВАНИЯ И НИТРОВАНИЯ
Лекция 30 ПРОЦЕССЫ СУЛЬФАТИРОВАНИЯ
Теоретические основы процессов сульфатирования.
Технология сульфатирование спиртов и олефинов. Принципиальная технологическая схема, реакционные узлы
Теоретические основы процессов сульфатирования.
Сульфатированием называют реакции образования сложных эфиров серной кислоты — алкилсульфатов ROSO2OH. Сульфатирование представляет собой частный случай рассмотренных ранее реакций этерификации.
Практическое значение процессов сульфатирования очень велико. Алкилсульфаты являются наиболее распространенными из синтетических ПАВ. Масштабы производства 1300 тыс. т анионоактивных ПАВ типа алкилсульфатов.
Сульфатирование спиртов применяют главным образом для получения ПАВ типа алкилсульфатов; его можно осуществлять при помощи серной, хлорсульфоновой и сульфаминовой кислот, а также серного ангидрида.
Традиционным является взаимодействие спиртов с серной кислотой, представляющее собой обратимую реакцию этерификации:
ROH + H,SO4 ↔ ROSO2OH + H2О
При
эквимольном соотношении  реагентов
равновесная степень превращения
первичных спиртов составляет ≈ 65%, падая
до 40÷45% для вторичных спиртов и становясь
совсем незначительной для третичных.
В этом же направлении изменяется и
реакционная способность спиртов: для
первичных ≈ в 10 раз больше, чем для
вторичных. Реакция сульфатирования
сильно экзотермична, но главным образом
из-за тепла, выделяющегося при разбавлении
серной кислоты спиртом и образующейся
водой. Вследствие этого тепловой эффект
зависит от концентрации серной кислоты
и от ее мольного отношения к спирту (при
взаимодействии 1 моль спирта с 1,9 моль
100%-ной серной кислоты он составляет 117
кДж/моль (28 ккал/моль)).
реагентов
равновесная степень превращения
первичных спиртов составляет ≈ 65%, падая
до 40÷45% для вторичных спиртов и становясь
совсем незначительной для третичных.
В этом же направлении изменяется и
реакционная способность спиртов: для
первичных ≈ в 10 раз больше, чем для
вторичных. Реакция сульфатирования
сильно экзотермична, но главным образом
из-за тепла, выделяющегося при разбавлении
серной кислоты спиртом и образующейся
водой. Вследствие этого тепловой эффект
зависит от концентрации серной кислоты
и от ее мольного отношения к спирту (при
взаимодействии 1 моль спирта с 1,9 моль
100%-ной серной кислоты он составляет 117
кДж/моль (28 ккал/моль)).
Для повышения равновесной степени конверсии спирта применяют концентрированную кислоту (98÷100%-ную) в избытке по отношению к спирту (1,8÷2,0) : 1; тогда выход первичных алкилсульфатов достигает 80÷90%. С этой же целью предлагалось отгонять образующуюся воду с помощью азеотропообразователей (СС14) или в вакууме.
Механизм сульфатирования спиртов серной кислотой. Кислота выполняет одновременно роль и реагента и катализатора, а реакция протекает с разрывом связи S-О, что обусловливает отсутствие изомеризации в алкильной группе:
+Н+ +ROH; −Н2О −Н+
H2SO4 ↔ Н2О+−SO2OH ↔ RHO+−SO2OH ↔ ROSO2OH
Этому механизму соответствует кинетическое уравнение
r
=
k1∙h0
![]()
При сульфатировании получается ряд побочных продуктов. Так, зa счет дегидратирующего действия серной кислоты образуются олефины, выход которых растет для вторичных и особенно для третичных спиртов. Из-за окисляющего влияния серной кислоты образуются альдегиды и кетоны, способные к дальнейшему осмолению и конденсации (при получении ПАВ это ведет к потемнению продукта и снижению его качества). Поскольку образование олефинов и карбонильных соединений растет с повышением температуры, то оптимальной является температура равная 20÷40°С. По этой же причине исключается применение олеума в качестве сульфатирующего агента.
С другими сульфатирующими агентами реакция становится необратимой. С сульфаминовой кислотой она протекает по уравнению:
H2NSO2OH + ROH → ROSO2ONH4
Сульфаминовая кислота как сульфатирующий агент мало активна и обладает «мягким» действием: реакция ее со спиртами протекает при 100÷125°С. Ввиду сравнительно высокой стоимости сульфаминовую кислоту применяют лишь в специальных случаях, когда другие сульфатирующие агенты дают нежелательную смесь продуктов.
Для сульфатирования спиртов применение нашла хлорсульфоновая кислота. Она обладает высокой реакционной способностью - реакция протекает с большой скоростью уже при комнатной температуре, имеет первый порядок по кислоте и спирту и состоит в атаке атома серы молекулой спирта:

Несмотря на высокую активность хлорсульфоновая кислота обладает «мягким» действием, и реакция протекает почти с теоретическим выходом. При повышении температуры и особенно при сульфатировании вторичных спиртов растет образование хлорпроизводных: ROH + НС1 → RC1 + Н2О, которое можно подавить, снижая температуру и быстро удаляя НС1.
В последнее время в качестве сульфатирующего агента приобрел большое значение серный ангидрид. Его электрофильные свойства обусловлены наличием вакантных орбиталей; за их счет он может связываться с кислородным атомом спирта, образуя комплекс, который превращается в алкилсерную кислоту, химическая реакция протекает практически мгновенно:

Сульфатирование олефинов с H2SO4 протекает последовательно с образованием моно- и диалкилсульфатов, полимеров олефина, а если в серной кислоте есть вода, − с образованием также спирта и простого эфира. Реакция идет через промежуточное образование иона карбония:
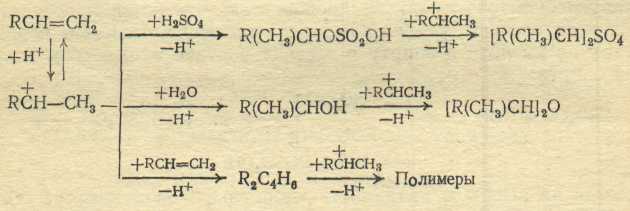
Кроме того, образование спирта и простого эфира обусловлено обратимыми реакциями гидролиза и алкоголиза моно- и особенно диалкилсульфата, обладающего сильными алкилирующими свойствами:
+Н2О +Н2О
R2SO4 → ROSO2OH + ROH ↔ H2SO4 + 2ROH
+ROH +ROH
R2SO4 → ROSO2OH + ROR ↔ H2SO4 + 2ROR
Получаются также продукты окисления и (за счет конденсации) смолистые вещества, ухудшающие качество ПАВ. Поскольку целевым продуктом при получении ПАВ является моноалкилсульфат на практике всегда мольное отношение олефина и H2SO4 берут близким к 1 : 1. При этом во избежание чрезмерной полимеризации олефина, осмоления, а также образования диалкилсульфата и простого эфира оказалось оптимальным применение 92÷93%-ной серной кислоты и температуры 0÷40 °С.
Механизм сульфатирования олефинов:

Сама
реакция н-олефинов
с серной кислотой при умеренных условиях
практически необратима и высокоэкзотермична
(-![]() =
88кДж/моль (21ккал/моль).
=
88кДж/моль (21ккал/моль).
Кинетика
описывается уравнением:![]()
Видно, что скорость реакции растет с повышением кислотности среды (h0), которая сильно зависит от концентрации серной кислоты. Процесс сульфатирования олефинов при интенсивном перемешивании и теплопередаче протекает в течение ≈ 1 мин, но обычная его длительность ≈ 1 ч.
2. Технология сульфатирования олефинов и спиртов. Принципиальная технологическая схема. Реакционные узлы
ПАВ типа алкилсульфатов можно разделить на три главные группы.
Первичные алкилсульфаты, получаемые из первичных спиртов с линейной углеродной цепью. Эти спирты частично являются продуктами гидролиза природных жиров (лауриловый С12Н23ОН, миристиловый С14Н29ОН), но большей частью их синтезируют путем гидрирования высших жирных кислот, получаемых окислением парафина, алюминийорганическим синтезом или оксосинтезом. В последних случаях сырьем оказываются смеси первичных спиртов с подходящей длиной алкильной группы.
Вторичные алкилсульфаты (типолы), получаемые из H2SO4 и олефинов линейного строения (α-олефины, получаемые термическим крекингом парафина или алюминийорганическим синтезом), а также из вторичных спиртов, получаемых прямым окислением мягкого парафина.
3. Эфиросульфаты, получаемые сульфатированием продуктов присоединения 2÷3 моль оксида этилена к спиртам или алкилфенолам:
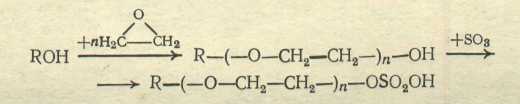
Поверхностно-активные свойства алкилсульфатов зависят от строения и длины алкильной группы, а также от положения сульфатного остатка в ней. Эти свойства сильно снижаются при разветвлении углеродной цепи, что послужило одной из причин использования для их синтеза спиртов и олефинов линейного строения (другая причина состоит в том, что разветвление цепи приводит к плохой биоразлагаемости ПАВ).
Максимальная моющая способность наблюдается у алкилсульфатов с концевым положением сульфоэфирной группы (т. е. у первичных) и постепенно уменьшается, когда эта группа находится все дальше от конца цепи. Максимальная моющая способность для первичных алкилсульфатов достигается при 12÷16 углеродных атомах в цепи, а для вторичных алкилсульфатов при 15÷18. В случае 1-алкилсульфатов моющая способность изменяется в ряду:
Число атомов углерода 11 13 15 17 19
Моющая способность, % 20 40 120 140 130
На рис. 1 представлены реакционные узлы процессов сульфатирования.

Рис. 1- Реакционные узлы процессов сульфатирования.
а − аппарат с реакционной тарелкой (стакан); б − каскад реакторов с турбинными мешалками; в−аппарат с вращающимся внутренним барабаном; г− пленочный реактор.
В аппарате рис. 1-а сульфатирование проводят хлорсульфоновой кислотой, в реакторе имеется тарелка с бортиком (стакан), охлаждающими змеевиками и мешалкой. В цент тарелки подают хлорсульфоновую кислоту и спирт. Частично прореагировавшая смесь стекает через бортик на стенки корпуса, охлаждаемые рубашкой.
Другие варианты оформления реакционного узла при сульфатировании спиртов серным ангидридом тоже изображены на рис. 1-б, в и г.
В одном из них (рис.1-б) применяют каскад из двух-трех реакторов с турбинными мешалками, охлаждающими змеевиками и рубашками. Внутри реактора благодаря цилиндрическому кожуху создается высокотурбулентный вертикальный поток смеси, обеспечивающий интенсивную циркуляцию и теплоотвод. При этом жидкость движется последовательно через все реакторы каскада, а разбавленный воздухом SO3 подают параллельно в каждый из них.
В другом типе реактора (рис. 1-в) имеются кожух с охлаждающей рубашкой и внутренний вращающийся барабан; на его внешней поверхности есть штыри, способствующие лучшему перемешиванию и турбулизации потока реагентов, движущихся снизу вверх в узком кольцевом пространстве между кожухом и барабаном. Конструкция сложная, и сейчас применение находят пленочные реакторы.
Они бывают одно- и многотрубные (типа кожухотрубных теплообменников с пленкой жидкости, стекающей по трубам, и с охлаждением рассолом или водой, циркулирующими в межтрубном пространстве) (рис. 1-г). Органический реагент вводят сверху через специальные дозирующие устройства, что обеспечивает на стенках образование равномерно стекающей пленки жидкости. Разбавленный воздухом SO3 подают тоже сверху, прямотоком к жидкости, причем, чтобы SO3 не попадал в верхнюю часть реактора, туда вводят воздух, а разбавленный SO3 подают через специальные трубы, опущенные в реакционное пространство.
Технология сульфатирования. Сульфатирование серной кислотой спиртов и олефинов для получения ПАВ имеет много общего. Обе реакции осуществляют при пониженной температуре (0÷40°С), интенсивном охлаждении рассолом и перемешивании, необходимом для снятия диффузионных торможений и интенсификации теплопередачи. Рассмотрим технологию сульфатирования на примере сульфатирование спиртов серным ангидридом.
Преимущества: Необратимость и высокая скорость реакции обеспечивают возможность использования эквимольного соотношения реагентов при практически полном превращении их в алкилсерную кислоту. Это существенно снижает расход спирта и сульфатирующего агента. Побочных реакций нет. Следовательно, реакционная масса состоит почти из одной алкилсерной кислоты, что существенно упрощает ее дальнейшую переработку и дает ПАВ, не содержащее неорганических солей. Кроме того, серный ангидрид дешевле других сульфатирующих агентов. Поэтому сульфатирование серным ангидридом является сейчас наиболее перспективным и вытесняет другие способы.
Недостаток: очень высокая скорость и большая экзотермичность реакции, что приводило к перегревам смеси, развитию побочных реакций и потемнению продукта. Для чего применяют пары SO3, разбавленные воздухом до концентрации 4÷7% (об.). Это значительно замедлило диффузию SO3 из газовой фазы в жидкую и позволило справиться с отводом выделяющегося тепла.
Технологическая схема производства моющего средства на основе алкилсульфата изображена на рис. 2. В пленочный реактор 1 непрерывно подают спирт, воздух и пары SO3, разбавленные воздухом. Выходящие газы отделяют в сепараторе 2 от жидкости и направляют в абсорбер 3 для санитарной очистки от остатков SO3. Полученную алкилсерную кислоту нейтрализуют концентрированным раствором щелочи в аппарате 4, имеющем мешалку и выносной холодильник 5, через который жидкость прокачивается насосом. Температура при нейтрализации не должна превышать 60 °С. После этого в аппарате 6 с мешалкой проводится более точная нейтрализация смеси до рН=7. Нейтрализованная масса, содержащая алкилсульфат и воду, поступает далее в смеситель 7, где к ней добавляют другие компоненты моющего средства (фосфаты или пирофосфаты, сода, отбеливатели, карбоксиметилцеллюлоза). Эту смесь подают насосом в распылительную сушилку 8, вбрызгивая ее через специальные сопла в поток горячего топочного газа. Унесенные газом твердые частицы улавливают в циклоне 9.

Рисунок 2- Технологическая схема получения моющего средства на основе алкилсульфата
1 −реактор- 2 − сепаратор; 3 − абсорбер; 4, б − нейтрализаторы; 5 − холодильник; 7 − смеситель; 8−распылительная сушилка; 9 − циклон; 10 − шнек.
Порошкообразное моющее средство с низа сушилки и циклона транспортируют шнеком 10 на расфасовку.
r = k1∙h0
Рис. 1- Реакционные узлы процессов сульфатирования.
а − аппарат с реакционной тарелкой (стакан); б − каскад реакторов с турбинными мешалками; в−аппарат с вращающимся внутренним барабаном; г− пленочный реактор.
Рисунок 2- Технологическая схема получения моющего средства на основе алкилсульфата
1 −реактор- 2 − сепаратор; 3 − абсорбер; 4, б − нейтрализаторы; 5 − холодильник; 7 − смеситель; 8−распылительная сушилка; 9 − циклон; 10 − шнек.
