
Раздел 5. Химия и технология дегидрирования и гидрирования
Лекция 28. Гидрирование углеводородов
Химия гидрирования углеводородов
Технология гидрирования углеводородов.
2.1. Реакционные узлы процессов жидкофазного гидрирования
2.2. Технология жидкофазного гидрирования.
Химия гидрирования углеводородов
В промышленности ОО и НХС широко используют процессы гидрирования углеводородов, кислород- и азотсодержащих соединений с целью получения насыщенных углеводородов, кетонов, карбоновых кислот, спиртов и аминов.
Гидрирование парафинов
Гидрокрекинг алканов обычно осуществляется на бифункциональных катализаторах, активных как в реакциях крекинга, так и в реакциях гидрирования. Крекирующую функцию катализатора обеспечивает соединение кислотного характера, направляющие реакцию по карбокатионному механизму (Al2O3, алюмосиликаты, цеолиты), а гидрирующую – в основном металлы. VIII группы (Fe, Co, Ni, Pt, Pd и т.д.)
Первой стадией образования алканов является расщепление и часто изомеризация.
СH3СH2СH2 СH3 + H2 → СH3СH3 + СH3СH3
Скорость разрыва различных С – С связей зависит от типа катализатора. Тепловой эффект гидрирования алканов суммируется из эндотермических реакций гидрирования и колеблется в широких пределах в зависимости от исходного парафина. Превращения циклоалканов в присутствии гидрирующих катализаторов заключается в основном в расщеплении кольца по всем возможным связям, с последующим насыщением образующихся осколков водородом. В случае замещенных циклоалканов преимущественно разрывается β- связь по отношению к заместителю. В общем случае, например:
 →
СH3СH2
СH2СH(СH3)СH3
→
СH3СH2
СH2СH(СH3)СH3
С6Н5-СН3 + Н2 → СH3 СH2СH(СH3)СH2СH3
→ СH3СH2СH2СH2СH2СH3
Гидрирование олефинов
Соотношение скоростей реакций расщепления олефинов и гидрирование по С=С – связи определяется типом и активностью катализатора. Так, на катализаторах с высокой кислотной активностью олефины превращаются в карбокатионы:
К-Н + СH2 =СHСH2СH2СH2СH3 → К- + СH3-СН+СH2СH2СH2СH3
которые затем изомеризуются в результате переноса гидроиона (Н-)
СH3-СН+СH2СH2СH2СH3 → СH3СH2СН+СH2СH2СH3
и претерпевают β – расход по наиболее слабой β – С-С связи.
СH3СH2 СН+СH2СH2СH3 → СH3СH2СH=СH2 + С+H2СH3
Это приводит к образованию более низкомолекулярных, чем исходный, олефинов и насыщенных изосоединений. На катализаторах с высокой гидрирующей способностью происходит образование насыщенных углеводородов (с незначительной степенью изомеризованности).
Рассмотрим более подробно гидрирование по С=С – связи углеводородов. Для его проведения в настоящее время используют металлический Ni и Ni на Al2O3, Ni на Cr2O3 или Ni на других носителях. Эти контакты обеспечивают высокую скорость реакции при 100÷2000С и давлении Н2 1÷2 МПа. При наличии в исходном сырье сернистых соединений применяют стойкие к ним катализаторы (сульфиды Ni,W, Mo) при 300÷3200С и 25÷39 МПа.
Гидрирование олефинов по С=С – связи протекают очень легко и почти с теоретическим выходом. Ряд реакционноспособности олефинов к гидрированию: СH2=СH2 > R-СH=СH2 > R-СH=СH- R > R2СH=СH2 > R2СH=СHR > R2СH=СHR2.
Диеновые углеводороды с прямой цепью гидрируются быстрее олефинов. Более глубокое гидрирование приводит к парафинам.
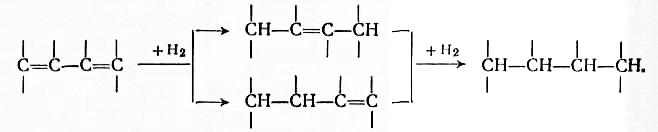
В циклоолефинах двойная связь присоединяет водород. Трех- четырехциклические соединения обычно цикл раскрывается.
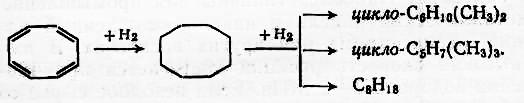
Эти побочные реакции ограничивают выбором температуры процесса. Гидрирование олефинов и диенов по С=С – связи широко используется при стабилизации крекинга бензина, селективной очистке жидких продуктов пиролиза от олефинов и т.д.
Гидрирование ацетилена и его гомологов
Ацетилен и его гомологи гидрируются медленнее олефинов аналогичного строения. В свою очередь олефины менее способны к сорбции на поверхности катализатора. Эти факторы позволяют получать олефины в виде целевых продуктов. Так, селективное гидрирование до олефинов осуществимо при катализе платиной и палладием на носителях, а также молибдатами кобальта и никеля, железом и др. При большем времени контакта гидрирование идет до парафина:
СH≡СH + Н2 → СH2=СH2 + Н2 → СH3-СH3
Способность к гидрированию ацетиленовых углеводородов следующая: СH≡СH > СH3-С≡СH > СH3-С≡С-СH3 > СH3С≡С-СH2-СH3.
Гидрирование ароматических углеводородов
Сравнительная способность ароматической системы обусловливает её меньшую реакционную способность по сравнению с олефинами. Ниже приводится отношение скорости гидрирования (в условных единицах) бензола в ядро, циклоолефина и двойной связи в боковой цепи арифлолефина:
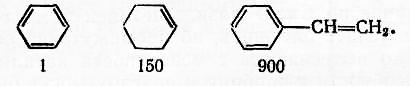
По этой причине, например, при ступенчатом гидрировании бензола в реакционной массе отсутствуют циклические олефины:
![]()
Гомологи бензола гидрируются с меньшей скоростью, чем предыдущий гомолог, что объясняется дезактивирующим влиянием заместителя при гидрируемых связях.
![]()
Катализаторами гидрирования ароматических систем могут быть все металлы VIII группы периодической системы элементов. Но промышленное применение нашел в основном Ni на носителях, особенно на Cr2O3. Процесс хорошо идет при 120÷2000С и давлении до 1÷5 МПа. Это необходимо не только для ускорения реакции, но для увеличения конверсии сырья (термические характеристики для ароматических углеводородов менее благоприятны для гидрирования, чем у олефинов).
Ненасыщенные связи в боковой цепи ароматического углеводорода гидрируется в первую очередь, но общий результат зависит от природы катализатора:
![]()
Ароматические углеводороды с конденсированными ядрами обычно гидрируются ступенчато:
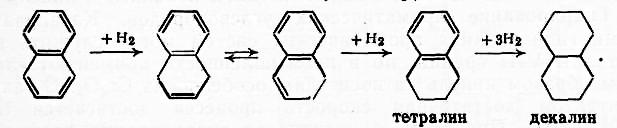
Побочные реакции гидрогенолиза ароматических углеводородов протекают с расщеплением боковых цепей и циклов:
![]()
При более мягких условиях протекает расщепление боковых цепей. Эти побочные реакции определяют верхний предел температуры и др. условия.
Гидрированием ароматических углеводородов получают цепные для народного хозяйства химические продукты, например, из бензола циклогексан.
Процессы гидрирования углеводородов можно проводить как в жидкой так и в газовой фазах (в зависимости от термостабильности других свойств гидрируемых субстратов).
В жидкофазном процессе, например, с использованием гетерогенного контакта реакционная масса представляет собой трехфазную систему (жидкий реагент, твердый катализатор и газообразный водород). Реакция протекает на поверхности катализатора. Её скорость при прочих равных условиях зависит от концентрации водорода в жидкой массе, скорости растворения в ней и скорости диффузии к поверхности катализатора. Интенсификации процесса способствует высокое давление водорода и перемешивание реакционной массы.
