Лекция 25. Дегидрирование и окисление спиртов
1. Теоретические основы дегидрирования спиртов
2. Реакционный узел. Технология получения формальдегида.
1. Теоретические основы дегидрирования спиртов
Данный процесс в настоящее время применяется только для дегидрирования и окисления вторичных спиртов в кетоны и метанола в формальдегид.
Дегидрирование и окисление вторичных спиртов. Этим методом получают частично ацетон (из изопропанола), метилэтилкетон (из втор-бутанола) и циклогексанон (из циклогексанола). В первых двух случаях рассматриваемому процессу предшествует стадия гидратации соответствующего олефина:
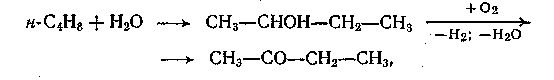
а в последнем - окисление циклогексана или гидрирование фенола:
![]()
Равновесие реакций дегидрирования вторичных спиртов значительно сдвинуто вправо уже при 250÷300°С, но процесс осуществляют при 400÷450°С, когда реакция становится практически необратимой. Катализаторами служат медь, оксид цинка, серебро на пемзе и др. Побочно происходит дегидратация спирта, с образованием олефина, но селективность по кетону высока - достигает 98%. Это позволяет работать при 80÷90 %-й степени конверсии с рециркуляцией непревращенного спирта на дегидрирование.
Значительная эндотермичность дегидрирования обусловливает применение трубчатых реакторов, в межтрубном пространстве которых циркулируют горячие газы от сжигания газообразного или жидкого топлива.
2. Реакционный узел. Технология получения
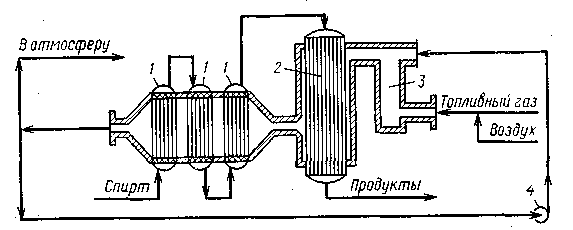
Схема реакционного узла для дегидрирования спиртов представлена на рис. 1. В топке 3 происходит сгорание топливного газа, подаваемого вместе с воздухом через специальные форсунки. Температура топочных газов слишком высока, поэтому их разбавляют обратным газом (циркуляция его в системе осуществляется газодувкой 4). Спирт поступает вначале в систему испарителей-перегревателей 1, где он нагревается до нужной температуры частично охлажденными топочными газами. Затем пары спирта попадают в реактор 2, где в трубах находится катализатор. Реакционная смесь подогревается горячими топочными газами, находящимися в меж трубном пространстве, что компенсирует поглощение тепла из-за эндотермичности процесса. По выходе из контактного аппарата реакционные газы охлаждают в холодильнике-конденсаторе (на рисунке не показан), а в случае летучих продуктов их дополнительно улавливают водой. Полученный конденсат (и водные растворы) ректифицируют, выделяя целевой продукт и непрореагировавший спирт, возвращаемый на дегидрирование.
|
Рис. 1. Реакционный узел для дегидрирования спиртов. 1- испарители-перегреватели; 2 - трубчатый реактор; 3 - топка; 4 - газодувка |
Процесс окисления вторичных спиртов имеет ряд преимуществ по сравнению с процессом дегидрирования: необратимость, экзотермичность и высокая скорость реакции, позволяющая интенсифицировать процесс и создавать установки большой единичной мощности. Выход кетонов также остается достаточно высоким, особенно при получении ацетона и метилэтилкетона (более 95%). Катализаторами реакции окисления могут служить медь и серебро, осажденное на пемзе или А12Оз. При повышенной температуре (400÷500°С) процесс протекает во внешнедиффузионной области гетерогенного катализа.
Применяются адиабатические реакторы со сплошным слоем гетерогенного катализатора. Состав исходной смеси спирта и воздуха ограничивается нижним пределом взрываемости соответствующей смеси. После рекуперации тепла горячих реакционных газов и охлаждения ацетон или метилэтилкетон абсорбируют водой, а чистые продукты получают при ректификации их водных растворов, возвращая воду на стадию абсорбции. Из-за экономических соображений не нашедшие достойного применения.
Дегидрирование первичных спиртов, в том числе метанола, менее благоприятно по сравнению с вторичными спиртами по условиям равновесия и селективности реакции. По этой причине, а также с целью устранения эндотермичности процесса осуществили совмещенное дегидрирование и окисление метанола:
![]()
Соотношение этих реакций подбирается так, что суммарная реакция будет экзотермична настолько, чтобы возместить потери тепла в окружающую среду и нагреть исходную смесь до нужной температуры. Практически при получении формальдегида такое положение достигается, когда процесс на 55 % идет через окисление и на 45 % через дегидрирование, и тогда процесс можно осуществить в адиабатических реакторах, не имеющих поверхностей теплообмена. В этом состоит одно из преимуществ совмещенного процесса окисления и дегидрирования спиртов. При указанном соотношении реакций дегидрирования и окисления исходная паровоздушная смесь должна содержать ≈45% (об.) метанола, что находится за верхним пределом взрываемости метанола в воздухе [34,7 % (об.)].
При получении формальдегида кроме основных реакций протекают побочные процессы более глубокого окисления, дегидрирования и гидрирования, ведущие к образованию оксидов углерода, муравьиной кислоты, воды и метана:
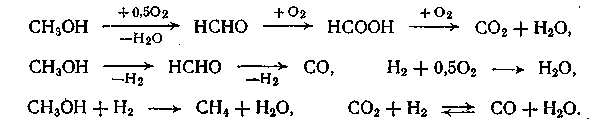
Окислительное дегидрирование проводят при недостатке кислорода, поэтому глубокое окисление не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, и побочные реакции не так заметны, как при дегидрировании других первичных спиртов. Это позволяет проводить реакцию при более высокой температуре (500÷600СС), большой скорости и времени контакта 0,01÷0,03 с. Выход формальдегида на пропущенное сырье достигает 80÷85 % при степени конверсии метанола 85÷90 %. Замечено, что добавление воды к исходному метанолу повышает выход и степень конверсии, результате разложения ацеталей. Катализаторами синтеза формальдегида этим методом служит металлическая медь (в виде сетки или стружек) или серебро, осажденное на А12О3. Последний катализатор оказался более эффективным и широко применяется в промышленности.
Дегидрированием или окислением первичных спиртов получают только формальдегид (из метанола).
Формальдегид НСНО представляет собой в безводном состоянии бесцветный газ с острым раздражающим запахом (т. конд. Минус 19°С при ≈0,1 МПа). При хранении он легко полимеризуется и нередко выпускается в виде твердого полимера — параформальдегида (параформ), который легко деполимеризуется. Параформ является линейным полимером с повторяющимися оксиметиленовыми звеньями (число их от 8 до 100):
![]()
Большей частью формальдегид выпускают в виде 37%-го водного раствора, называемого формалином. В нем формальдегид присутствует в виде гидрата НСНО-Н2О и низкомолекулярных полимеров (полиоксиметиленгликоли-). Во избежание более глубокой полимеризации и выпадения осадка к формалину добавляют 7÷12,% (масс.) метанола в качестве стабилизатора.
Формальдегид выпускают в очень крупных масштабах и применяют для производства ряда полимеров (феноло-, карбамидо- и меламиноформальдегидные полимеры, полиформальдегид) и в качестве промежуточного вещества для синтеза изопрена, пентаэритрита, гексаметилентетрамина (уротропин) и других ценных веществ.
Кроме встречавшегося ранее способа окисления низших парафинов, главную массу формальдегида производят из метанола двумя методами - дегидрированием, совмещенным с частичным окислением, и окислением в избытке воздуха.
Технологическая схема производства формальдегида окислительным дегидрированием метанола изображена на рис. 2. Метанол, содержащий 10÷12% воды, из напорного бака 1 непрерывно поступает в испаритель 2. Туда же через распределительное устройство подают воздух, очищенный от пыли и других загрязнений. Воздух барботирует через слой водного метанола в нижней части испарителя и насыщается его парами. В 1 л образующейся паровоздушной смеси должно содержаться ≈0,5 г метанола. Поддержание такого состава смеси очень важно для обеспечения взрывобезопасности и нормального протекания процесса. Поэтому работа испарительной системы полностью автоматизирована: поддерживают постоянные уровень жидкости в испарителе, ее температуру (48÷50°C) и скорость подачи воздуха, благодаря чему обеспечиваются необходимые температурный режим и степень конверсии в адиабатическом реакторе.
Паровоздушная смесь проходит брызгоуловитель, находящийся в верхней части испарителя, затем перегреватель 3 и поступает в реактор 4, в средней части которого находится катализатор. Реакционные газы сразу же попадают в подконтактный холодильник 5 (смонтирован вместе с реактором), где происходит быстрое охлаждение смеси и предотвращается распад формальдегида. В разных схемах охлаждение осуществляют проточной водой или паровым конденсатом, когда холодильник играет роль генератора пара низкого, среднего или даже высокого давления. Полученный пар (или горячая вода) служит для перегрева поступающей смеси в перегревателе 3 и для обогрева испарителя 2.
|
Рис. 2. Технологическая схема производства формалина.
1-напорный бак; 2 - испаритель; 3 - перегреватель; 4 - реактор; 5, 8 - холодильники; 6 -абсорбер; 7 -скруббер; 9- сборник |
Охлажденные реакционные газы поступают в абсорбер 6, выполненный в виде тарельчатой колонны; жидкость на тарелках охлаждают внутренними или выносными холодильниками (на схеме не изображены). Абсорбер орошают таким количеством воды, чтобы в кубе получился 36÷37%-й формалин. Стадии абсорбции и разделения продуктов оформляют двумя разными способами.
По одному из них в абсорбере поглощают как формальдегид, так и непревращенный метанол, который содержится в продуктах реакции в количестве, как раз достаточном для стабилизации формальдегида. В этом случае верхнюю тарелку абсорбера охлаждают рассолом, а колонна 7 служит лишь для санитарной очистки газа, в то время как для получения безмета-нольного формалина (требуемого иногда для различных целей) необходима установка для отгонки метанола.
При втором способе в абсорбере поглощают преимущественно формальдегид; тогда скруббер 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера 6 охлаждают в холодильнике 8 и собирают в сборнике 9.
Окисление метанола в формальдегид
Является новым, недавно разработанным и реализованным в промышленности процессом. Его осуществляют в избытке воздуха при 350÷430°С и атмосферном давлении с оксидным железомолибденовым катализатором [твердый раствор МоО3 в Fе2(МоО4)3], работающим по окислительно-восстановительному механизму с участием кислорода решетки. Процесс отличается высокими степенью конверсии метанола (99%) и селективностью (95÷96%), а также сильной экзотермичностью, что заставляет использовать трубчатые реакторы с охлаждением подходящим теплоносителем. Таковым на разных установках является кипящая под давлением вода или промежуточный теплоноситель, с помощью которого генерируют пар давлением до 3 МПа, Этого пара хватает для всех внутренних нужд, в том числе для привода воздушного турбокомпрессора, а избыток пара (1,8 т на 1т формальдегида) используют для других целей. Несмотря на более высокие капиталовложения и металлоемкость реакционного узла, а также на меньшую производительность катализатора, процесс окисления метанола в формальдегид получает все более широкое распространение из-за снижения затрат сырья, высоких степени конверсии метанола и энерготехнологической эффективности производства.
|
|
|||
|
|
Рис. 1. Реакционный узел для дегидрирования спиртов. 1- испарители-перегреватели; 2 - трубчатый реактор; 3 - топка; 4 - газодувка |
|
|
|
|
Рис. 2. Технологическая схема производства формалина.
1-напорный бак; 2 - испаритель; 3 - перегреватель; 4 - реактор; 5, 8 - холодильники; 6 -абсорбер; 7 -скруббер; 9- сборник |
|
|