
- •Раздел 5. Химия и технология дегидрирования и гидрирования
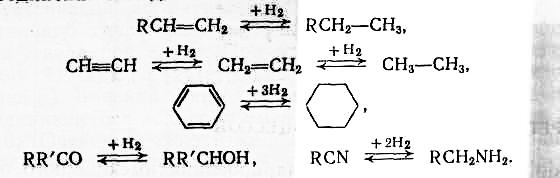
- •Процессы дегидрирования и гидрирования. Классификация реакций дегидрирования и гидрирования
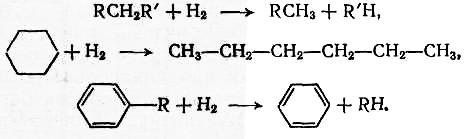
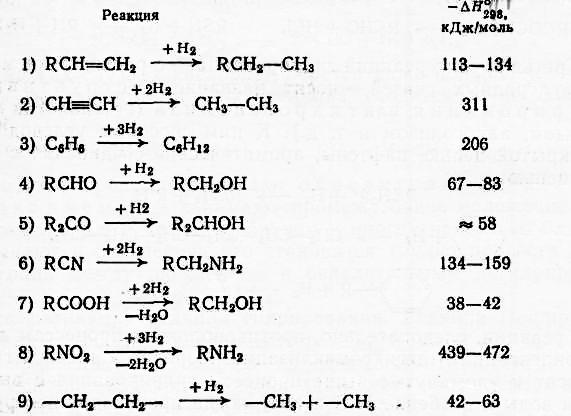
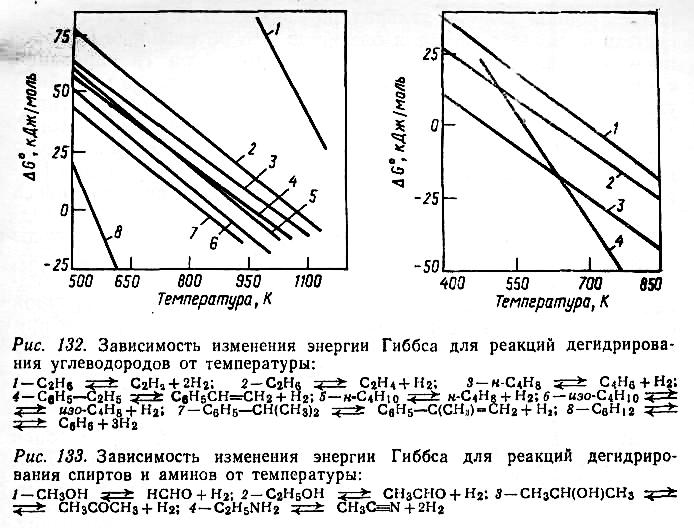
- •Теоретические основы реакций гидрирования и дегидрирования
- •Катализаторы реакций гидрирования и дегидрирования
- •Механизм и кинетика гидрирования и дегидрирования
Катализаторы реакций гидрирования и дегидрирования
Кроме термических превращений, все реакции гидрирования и дегидрирования − каталитические. Применение катализаторов позволяет достигнуть высокой скорости процессов при сравнительно низкой температуре, когда еще не получают значительного развития нежелательные побочные реакции. Ввиду обратимости реакций дегидрирования - гидрирования и способности любых катализаторов одинаково ускорять как прямой, так и обратный процесс, обе эти реакции катализируются одними и теми же веществами. Их можно разделить на три главные группы:
металлы VIII группы (Fe, Co, Ni, Pd, Pt) и 1Б подгруппы (Си, Ag) периодической системы, а также смеси этих металлов (сплавы);
оксиды металлов (MgO, ZnO, Сг2О3, Fe2O3 и др.);
сложные оксидные и сульфидные катализаторы, состоящие из смеси оксидов или сульфидов (медь- и цинкхромоксидные CuO·Cr2O3 и ZnO·Cr2O3, кобальтмолибденоксидные - СоО·МоО3, никель- и кобальтвольфрамоксидные - NiO·WO3, CoO·WO3).
Эти вещества, особенно металлы, часто наносят на пористые носители и добавляют к ним различные промоторы - оксиды других металлов, щелочи и др. Катализаторы применяют в разных формах - от тонкодиспергированных в жидкости до формованных (в виде цилиндров, колец, таблеток). Они обладают разной активностью и селективностью для каждого конкретного процесса, причем пока не найдено каких-либо общих закономерностей, определяющих оптимальный выбор катализатора.
Механизм и кинетика гидрирования и дегидрирования
Механизм реакций гидрирования и дегидрирования
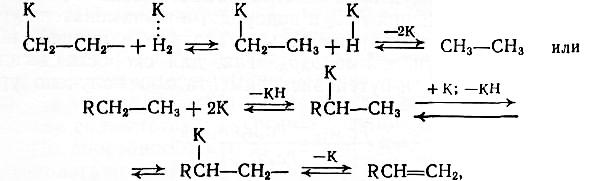
Эти процессы относятся к типу гомолитических превращений. Важную роль играет хемосорбция реагентов на активных центрах (К), при которой за счет электронных переходов с участием катализатора ослабляются или полностью разрываются химические связи в адсорбированной молекуле. Водород сорбируется металлами (кt), за физической адсорбцией следуют частичное ослабление связей и диссоциация молекулы:
![]()
Насыщенные углеводороды сорбируются в меньшей степени, но для них также возможна диссоциация по С—Н-связи:
![]()
Олефины, арены, ацетилен и его гомологи обладают высокой способностью к сорбции, которая протекает в основном за счет частичного или полного раскрытия ненасыщенной связи:
![]()
Оксидные катализаторы ведут себя подобным же образом, но их способность к хемосорбции водорода и углеводородов меньше, чем у металлов. Органические кислород- и азотсодержащие соединения лучше сорбируются на оксидных катализаторах, чем на металлах.
Дальнейшее взаимодействие протекает между двумя хемо-сорбированными частицами, находящимися на соседних активных центрах поверхности, или между хемосорбированной частицей и физически адсорбированной или налетающей из объема молекулой. При этом в равновесных процессах гидрирования — дегидрирования обратима каждая элементарная стадия:

Кинетика реакций гидрирования и дегидрирования.
Скорость этих реакций, как и для других гетерогенно-каталитических процессов, в общем случае может зависеть от диффузионных и кинетических факторов. Первые из них играют тем меньшую роль, чем интенсивнее перемешивание и турбулентность потоков и чем ниже температура. В большинстве случаев кинетика гидрирования и дегидрирования описывается общим уравнением Лэнгмюра − Хиншельвуда:
![]()
В зависимости от величины адсорбционных коэффициентов это уравнение часто упрощаются.
![]()
Способность к дегидрированию на оксидных катализаторах уменьшается в ряду: спирты > амины > алкилбензолы > парафины, увеличиваясь при удлинении и разветвлении углеродной цепи.
Процессы гидрирования обычно осуществляются в условиях, когда равновесие значительно смещено вправо, и можно пренебречь обратной реакцией дегидрирования. Кроме того, насыщенный продукт гидрирования имеет небольшой адсорбционный коэффициент и поэтому обычно не входит в кинетическое уравнение процесса:
![]()
По способности к гидрированию разные классы соединений располагаются в следующие ряды: Олефины > Ацетилен и его производные > Ароматические углеводороды; Альдегиды > Кетоны > Нитрилы > Карбоновые кислоты.
Селективность реакций гидрирования и дегидрирования.
Селективность реакций гидрирования и дегидрирования зависит от следующих факторов:
Характера протекания реакции.
Типа используемого катализатора.
Реакционной способности исходного вещества, реагента и их способности адсорбироваться поверхностью (активными центрами) катализатора.
Температуры процесса.
Времени контакта и степени конверсии исходного вещества.
Типа реакционной аппаратуры и оформления технологии в целом.
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
