
Краткое описание работы
Основная цель – проведение термодинамического анализа процесса формирования полупроводникового соединения GeSe с p-типом проводимости.
В работе кратко описана структура, свойства и применение полупроводникового соединения. Был проведен анализ основного процесса, процессов сублимации компонентов А и B, построение и анализ P-T диаграмм. Также были найдены парциальные давления паров и температур компонентов и оценка окисления германия в реакторе.
При отсутствии в системе твердых фаз диаграмма состояния состоит из области существования одной жидкой фазы (так называемой области гомогенности)
Расскажем про свойства и применение соединения GeSe:
Pnma – 28 групп, ромбическая система, P – примитивная, ось симметрии n-го порядка и плоскости параллельные и перпендикулярные к ней – называется кристаллографической группой., если в Дж, то *1,6*10^-19.
Ковале́нтная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков.
Сингония - классификация кристаллографических групп симметрии.
СВОЙСТВА
Является полупроводником, ширина запрещенной зоны НЕБОЛЬШАЯ, примерно 0,8-1,1 эВ, если в Дж, то *1,6*10^-19. Высокая термическая стабильность, обладает пьезоэлектрическими свойствами – генерируется электрический заряд при приложении механического напряжения и наоборот.
ПРИМЕНЕНИЕ
- Солнечные батареи – из-за низкого значения ширины запрещенной зоны и хорошей фотопроводимости.
- Пьезодатчики – устройство для измерения давления
- Полупроводниковые компоненты – транзисторы, диоды, интегральный схемы.
Энтропия (S) – мера энергии, которую невозможно извлечь из системы и превратить в полезную работу. (др. опр. – мера неопределенности или информационная емкость системы)
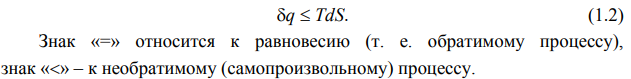
Энтальпия (H) – полная энергия системы (кол-во энергии, которую можно преобразовать в теплоту)
Энергия Гиббса (G) – свободная энергия системы, которую при обратном экзотермическом процессе (T=const) можно извлечь из системы и получить полезную работу
Верхний индекс «0» означает стандартное давление Р = 1 атм
Почему
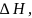 но
S?
но
S?
При
нуле Кельвина энтропия равна нулю,
поэтому пишется без дельты.

3 пункт курсовой.
Где используется з. Гесса, а где з. Кирхгофа.


В курсовой пользовались законом Кирхгофа.
Закон Гессе - Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Закон Кирхгофа - температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции
Уравнение изотермы:
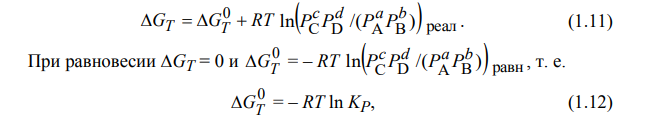
Данное уравнение используется чтобы перейти от стандартных парциальных давлений P =1 атм, к реальным парциальным давлениям.
Доп. Условие протекания
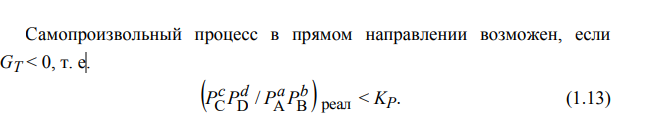
Основной критерий протекания процесса – константа равновесия
Если G<0 свободное протекание процесса, если G>0 прямой процесс запрещен, если равен нулю, то прямой и обратный запрещены.
Как выбирали рабочую точку?
Ответ: рабочая температура лежит в диапазоне от 0.7 до 0.9 температуры кипения соединения. Константа равновесия высчитывается исходя из условия T=750 K.
Константу равновесия мы берем немного меньше, чтобы перейти в область самопроизвольного протекания процесса в прямом направлении
Сублимация – переход из твердой фазы сразу в пар, минуя жидкую фазу.
Расчеты пункта 2 от 3 заключаются в том, что в пункте 2 мы рассматривали процессы при стандартных условиях и температурах << температур ф.п.. Пункт три строится на использовании з. Кирхгофа.
Температура кипения – такая температура, при которой температура пара вещества сравнивается с внешним давлением
Область гомогенности - область существования нестехиометрического соединения, в которой при изменении состава этого соединения тип его кристаллической структуры сохраняется неизменным.
ln a = 2,3 lg a
ЧТО ДОБАВИТЬ: ТОЧНЫЕ ОПРЕДЕЛЕНИЯ ЭНТРОПИИ И ЭНТАЛЬПИИ, ОПРЕДЕЛЕНИЕ ГОГ, ДЕФЕКТЫ
4 пункт: указать линию термодинамического p-n перехода (Termodinamikal p-n Junction) – показать на линию стехиометрии
