
- •Аннотация
- •Содержание
- •1 Краткое описание структуры, свойств и применения соедения
- •Описание структуры
- •Свойства и получение
- •Применение
- •Данные для термодинамического анализа
- •Анализ основного процесса
- •2.1 Расчет параметров реакции при стандартных условиях
- •2.2 Расчет параметров реакции при необходимых условиях
- •2.3 Выбор рабочей точки и анализ условий протекания процесса
- •Анализ процессов сублимации
- •Анализ сублимации и испарения олова Sn
- •Анализ сублимации серы s2
- •Построение Pi – t диаграмм и оценка диапазона изменения соотношения давлений реагирующих веществ
- •4.1 Определение границ области гомогенности для двух компонентов
- •4.2 Определение линии стехиометрии и построение pi – t диаграмм
- •Заключение
- •Список информационных источников
2.2 Расчет параметров реакции при необходимых условиях
Для расчета термодинамических параметров при температурах отличных от стандартной, необходимо воспользоваться законом Кирхгофа для одной фазы. Для изменения энтальпии (6) и для изменения энтропии (7)
Результаты расчета представлены в таблице 3.
|
(6) |
|
(7) |
Пример расчета для температуры 388 K






Далее по уравнению Гиббса-Гельмгольца для температуры 388 K

Логарифм константы равновесия при заданной температуре

Таблица 3 – Расчетные значения термодинамических величин
|
|
|
|
|
|
lg Kp |
298 |
3.356 |
-475.970 |
-205.600 |
-414.701 |
167.461 |
72.727 |
388 |
2.577 |
-476.315 |
-206.632 |
-396.143 |
122.862 |
53.358 |
505 |
1.980 |
-476.425 |
-206.892 |
-371.945 |
88.631 |
38.492 |
900 |
1.111 |
-473.965 |
-203.600 |
-290725 |
38.872 |
16.882 |
2.3 Выбор рабочей точки и анализ условий протекания процесса
На рисунке 3 представлен график зависимости логарифма константы равновесия от f (1/Т). Так же на графике обозначены области возможности и невозможности протекания реакции.
Рабочий диапазон температур равен 0.7…0.9 Тпл (SnS), то есть от 807.1 К до 1037.7 К. Рабочая температура, выбранная из полученного диапазона равна 900 К. Термодинамические параметры при заданной температуре представлены в таблице 3.
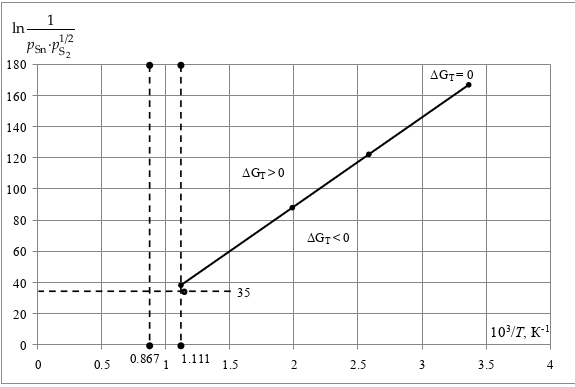
Рисунок 3 – Анализ возможности протекания процесса и выбор рабочей точки
При данной температуре значение логарифма константы равновесия – 38.872. Рабочая точка выбирается при этой же температуре, но с меньшим значением логарифма константы равновесия, для того что бы перейти в область самопроизвольного протекания процесса в прямом направлении (ΔGT < 0).
Условия, обеспечивающие протекание реакции исследуются с помощью уравнения изотермы химической реакции
|
(8) |
Тогда
условие равновесия в системе при 900K ( )
)


Условие
протекания в прямом направлении при
900K ( )
)
Невозможность
протекания в прямом направлении при
900K ( )
)
Тогда значение логарифма произведения реальных давлений паров принимается 35 < 38.872.
Анализ процессов сублимации
Анализ сублимации и испарения олова Sn
Уравнение реакции для процесса сублимации олова

Константа равновесия в данном случае будет только от парциального давления газообразного олова
|
|
Параметры реакции при температуре 298 К определяются по формулам (1)…(5)




В данном процессе необходимо учесть фазовый переход, поэтому рассчитываются теплоемкости при Т < Тфп и при Т > Тфп
(Т < Тфп)


(Т > Тфп)


При температурах выше Тпл изменение энтальпии (6) и изменение энтропии (7) находятся также по закону Кирхгофа, но в данном случае с учетом фазовых переходов. Результаты представлены в таблице 4.
Пример расчета для температуры 900 K








Далее по уравнению Гиббса-Гельмгольца для температуры 900 K

Логарифм константы равновесия при заданной температуре

Таблица 4 – Расчетные значения термодинамических величин для процесса сублимации олова
|
, К-1 |
|
|
|
|
lg Kp |
lg PSn |
298 |
3.356 |
301.500 |
117.300 |
266.545 |
-107.634 |
-46.745 |
-46.745 |
388 |
2.857 |
301.902 |
118.487 |
255.929 |
-79.376 |
-34.472 |
-34.472 |
505 |
1.548 |
302.229 |
119.236 |
242.014 |
-57.670 |
-25.046 |
-25.046 |
900 |
1.111 |
297.799 |
109.060 |
199.645 |
-26.690 |
-11.591 |
-11.591 |
Зависимость ln PSn от обратной температуры для олова представлена на рисунке 4.
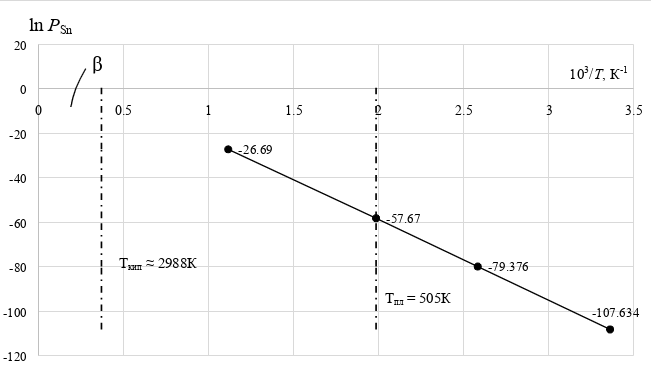

y = -35.631x + 11.918
Рисунок 4 – Зависимость ln PSn от обратной температуры
Представив логарифм давления пара олова в виде полинома



Получается уравнение аппроксимирующей прямой

Температура кипения находится из условия, что давления пара олова сравнивается с атмосферным и ln PSn = 0
Температура
кипения





 ,
К-1
,
К-1




