
Исправление Лабораторной работы №5.
1) Расчет молярной концентрации и титра раствора Na2CO3:
Сн ( 2 3) = 0,290 н
Мэк = |
|
|
|
|
|
|
( 2 |
3) |
= |
106 |
= 53( |
г |
) |
|||||||
|
(число кислотных остатков) (валентность кислотного остатка) |
1 2 |
моль |
|||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||
= |
нМэк |
|
= |
0,290 53 |
= 0,01537( |
г |
) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||
1000 |
|
1000 |
|
|
|
|
|
л |
|
|
|
|
|
|
||||||
|
|
|
|
1000 |
|
|
1000 0,01537 |
г |
|
|
|
|
|
|
||||||
См = |
|
= |
л |
= 0,145 М |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
( 2 3) |
106 |
г |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
моль |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2)Изменены единицы измерения Общего содержания щелочи:
( ) = н( ) 0,25 л = 0,0256 0,25 = 0,0064(моль)
МИНОБРНАУКИ РОССИИ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ «ЛЭТИ» ИМ. В.И. УЛЬЯНОВА (ЛЕНИНА) Кафедра физической химии
ОТЧЕТ по лабораторной работе №5
по дисциплине «Химия» Тема: Приготовление раствора электролита заданной концентрации
Студент гр. 1282 |
|
Козлов С.В. |
|
Преподаватель |
|
|
Рубцов Э.Р. |
Санкт-Петербург
2021
Цель работы.
Приготовление раствора соляной кислоты, нахождение его точной концентрации, определение общего содержания щелочи в растворе,
выданном преподавателем, и на основании известной концентрации выданного раствора расчет его объема.
Основные теоретические сведения.
Концентрация раствора является его основной количественной характеристикой. Способы выражения концентрации могут быть различными:
•, С % − массовая доля растворенного вещества (в долях или процентах);
•Сн. − молярная концентрация эквивалента нормальность (н.) выражается числом молей эквивалентов растворенного вещества, содержащихся в 1 л
раствора (моль л −1 );
•См − молярная концентрация (М − молярность) выражается числом молей растворенного вещества, содержащихся в 1 л раствора (моль л −1 );
•Т − титр раствора выражается числом граммов растворенного вещества,
содержащихся в 1 мл раствора (г мл−1 ). Раствор, концентрация которого точно известна, независимо от способа выражения концентрации, называется титрованным. Для точного определения значения концентраций раствора проводят операцию титрования. К определенному объему исследуемого раствора кислоты приливают понемногу из бюретки титрованный раствор щелочи или соды Na2CO3 − до тех пор, пока не будет установлено, что затраченное количество приливаемого реактива эквивалентно количеству определяемого вещества: пройдет реакция нейтрализации между кислотой и щелочью (или содой). При титровании необходимо как можно точнее устанавливать момент наступления эквивалентности − фиксировать точку эквивалентности. Для этого к исследуемому раствору добавляют несколько
капель индикатора − вещества, резко изменявшего свою окраску при изменении характера среды. В реакциях нейтрализации индикаторами могут служить растворы лакмуса, фенолфталеина и метилоранжа, изменяющие свою окраску при переходе от кислой среды к щелочной.
Обработка результатов.
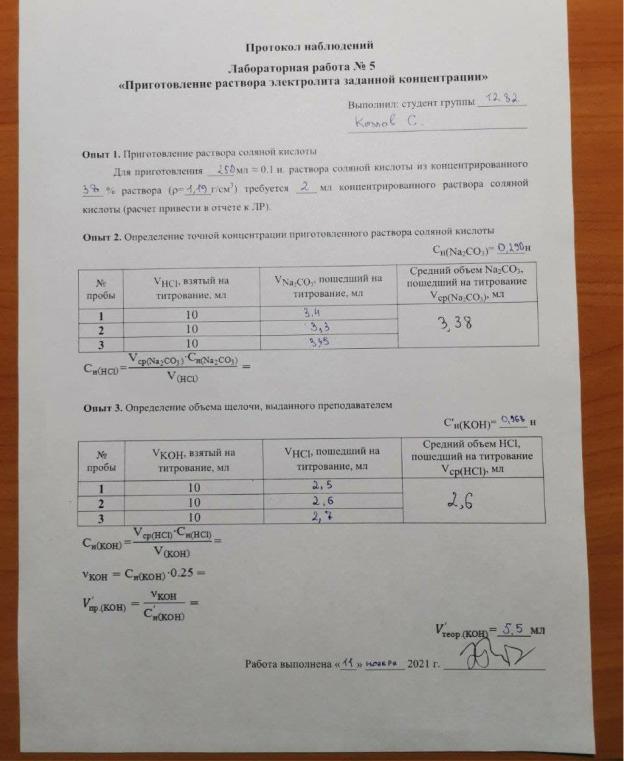
1. Необходимо приготовить 250 мл раствора 0.1 н раствора HCl из концентрированного раствора соляной кислоты, массовая доля которой 38% (ρHClконц=1,19 г/см3).
Дано: |
|
|
|
Решение: |
|
|
|
||||
VHClразб = 250мл |
1) Масса HCl, содержащаяся в указанном объеме |
||||||||||
ωHClконц = 38% |
разбавленного |
раствора |
|
находится |
из |
||||||
ρHClконц = 1,19 г/см3 |
соотношений: |
|
|
|
|
|
|||||
Сн=0,1н |
1л 1н. раствора |
соляной |
кислоты содержит |
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
молярную массу HCL, т.е. 36,46 г HCL, 0,1 л 1н |
||||||||||
Найти: |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
VHClконц – ? |
раствора – 3,646 г HCL, а 0,25 л – 0,9115 г HCL. |
||||||||||
Запишем: |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
38 г HCL |
100 г раств. |
|
|
|
||||||
|
0,9 г HCl |
|
m г раств. |
|
|
|
|||||
|
Составим пропорцию и выразим искомую m: |
|
|||||||||
|
= |
0,9 г 100 г |
= 2,37 г |
|
|||||||
|
|
|
38 г |
|
|||||||
|
|
|
|
|
|
|
|
|
|
||
|
2) |
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
= |
|
2,37 г |
|
= 2 мл |
|
||
|
|
|
|
|
3 |
|
|||||
|
|
|
|
|
1,19 г/см |
|
|||||
|
Ответ : 2 мл. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Определение концентрации приготовленного раствора HCl путем титрования раствором Na2CO3.
2HCl + Na2CO3 = 2NaCl + H2O + CO2
2H++2Cl-+2Na++CO32- = 2Na++2Cl-+H2O+ CO2
CO32- = H2O + CO2
При титровании использовался индикатор метилоранж, цвет менялся от
красного к желтому.
|
|
|
|
3,4 10−3 0,29 |
|
экв |
||
Сн( ) = |
р( 2С3) н( 2 3) |
= |
|
|
= 0,0986( |
|
) |
|
|
|
10 10−3 |
л |
|||||
|
|
|
|
|
|
|
|
|
Рассчитаем молярную концентрацию и титр приготовленного раствора HCl:
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
( ) |
|
= 36,5 ( г ) |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
основность |
|
|
1 |
|
моль |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
См |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мв−ва |
|
|
|
|||||||||||||||
|
( ) |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||||||||||||||||
|
|
|
= |
|
|
в−ва |
|
|
|
в−ва |
|
|
|
р−ра |
= |
|
|
в−ва |
|
= |
|
= 1 |
|
||||||||||||||
|
С |
н( ) |
М |
|
|
|
|
|
|
|
|
|
М |
М |
|
|
|
||||||||||||||||||||
|
|
|
в−ва р−ра |
|
|
|
|
|
в−ва |
|
|
|
|
|
в−ва |
|
|
в−ва |
|
|
|
||||||||||||||||
|
См |
|
|
|
= 0,0986 ( |
моль |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
( ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
= |
в−ва |
= |
|
в−ва |
|
|
= |
См р−ра,л Мв−ва |
= |
См Мв−ва |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
р−ра,мл |
|
|
р−ра,л1000 |
|
|
|
р−ра,л 1000 |
|
|
|
1000 |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
= |
0,986 (1 + 35,5) |
≈ 0,0036 = 3,6 10−3( |
г |
|
) |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мл |
|||||
3. Вычислим Нормальность раствора KOH ( |
|
|
|
), Титр |
|
|
и Молярность |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н( ) |
|
|
|
|
|
|
|
|
|
|||||
м( ).
HCl + KOH = KCl + H2O H++Cl++K++OH+ = K++ Cl++H2O H++OH- = H2O
Использовался индикатор фенолфталеин. Цвет поменялся на слабо – розовый,
а затем раствор обесцветился.
|
|
|
|
|
|
2,6 10−3 0,0986 |
|
экв |
||||||||||||||
Сн( ) = |
р( ) н( ) |
= |
|
|
|
|
|
|
|
|
|
|
|
|
≈ 0,0256 ( |
|
|
) |
||||
|
|
|
|
|
|
|
10 10−3 |
|
|
л |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
( ) |
|
|
= |
56 |
( |
|
г |
) |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
кислотность |
1 |
|
|
моль |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
Сн( )М ( ) |
|
0,0256 |
56 |
|
|
|
моль |
|
|
|||||||||||
См( ) = |
= |
1 |
= 0,0256 ( |
) |
||||||||||||||||||
|
|
|
|
56 |
|
|
||||||||||||||||
|
|
( ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
л |
||||||
|
Сн( ) |
|
|
0,0256 |
56 |
|
|
г |
г |
|||
|
|
|
1 |
|
|
|
||||||
= |
|
1 |
= |
|
|
≈ 0,00143 |
( |
|
) = 1,43 10−3( |
|
) |
|
|
|
|
|
|
|
|||||||
|
1000 |
|
1000 |
|
|
|
|
мл |
мл |
|||
|
|
|
|
|
|
|||||||
Определим общее содержание щелочи, выданной преподавателем:
( ) = н( ) 0,25 л = 0,0256 0,25 = 0,0064(н)
Вычислим объем:
` |
|
= |
|
= |
0,0064 |
= 6,61 мл |
|
|
|||||
|
|
`м( ) |
0,968 |
|
||
|
|
|
|
|||
Рассчитаем абсолютную и относительную погрешности в определении концентрации HCl и объем KOH:
Сн теор( ) = 0,1 н |
|
|
|
|
|||
Сн экс( ) = 0,958 н |
|
|
|
||||
Абсолютная погрешность: Пабс = Сн теор |
− Сн экс= 0,1 – 0,098 = 0,0024 |
||||||
Относительная погрешность: Потн = |
Сн теор −Сн экс |
= |
0,1−0,098 |
100% |
= 2% |
||
Сн теор |
0,1 |
||||||
|
|
|
|
||||
` теор = 5,5 мл` экс = 6,58 мл Пабс = | ` теор − ` экс |= |5,5 − 6,58 |= 1,08 мл
Потн = |
| ` теор − ` экс | |
= |
|5,5−6,58 | |
100% = 19,6% |
|
|
|||
|
` теор |
5,5 |
|
|
Вывод: сделан раствор HCl с концентрацией Сн=0.098 н. Погрешность составила 2%. Определено общее содержание щѐлочи в растворе
ν(KOH)=0.0064 н. Посчитан объем этого раствора V=6,61 мл с погрешностью
19,6%.
