
Предварительные вопросы:
От чего зависит скорость гомогенной реакции
Написать уравнения действующих масс для двух газов и газа с твердым телом, объяснить почему во втором случае концентрация твердого тела не учитывается
Что такое энергия активации, от чего зависит, а отчего нет
Что происходит с энергией активации при введении катализатора
Конспект
1)Скорость химической реакции зависит от многих
факторов, среди которых:
- природа и концентрация реагирующих веществ;
- температура;
- давление (для реакций с участием газов );
- присутствие катализаторов;
- среда (для реакций в растворах);
- интенсивность света (в фотохимических реакциях)
Количественная зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ.
Например, скорость реакции (mА + nB) записывается следующим образом:

где
k - константа скорости реакции, зависящая
от природы реагирующих веществ и
температуры;
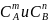 ,
- концентрации реагирующих веществ,
моль × л-1; m, n - стехиометрические
коэффициенты.
,
- концентрации реагирующих веществ,
моль × л-1; m, n - стехиометрические
коэффициенты.
Зависимость справедлива для газов и жидких веществ (гомогенные системы) и не распространяется на реакции с участием твердых веществ (гетерогенные системы).
Влияние температуры на скорость реакции
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на 10 °С увеличивается в 2-4 раза:

где
 - скорости при температурах t1, t2; γ -
температурный коэффициент скорости
реакции, принимающий значения 2-4 для
большинства реакций.
- скорости при температурах t1, t2; γ -
температурный коэффициент скорости
реакции, принимающий значения 2-4 для
большинства реакций.
При повышении температуры энергия вещества возрастает и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул. Энергия активации не зависит от температуры, она определяется только природой реагирующих веществ; это характеристический параметр химической реакции.
Согласно Аррениусу, зависимость константы скорости реакции от температуры описывается экспоненциальной функцией:

где Ea – энергия активации в Дж/моль, R – газовая постоянная, T – температура в K, A – предэкспоненциальный множитель (его размерность совпадает с k). Однако в малом температурном интервале Ea не зависит от температуры. Физический смысл множителя A состоит в том, что он характеризует предельное значение константы скорости при очень высоких температурах.
Константа скорости химической реакции зависит от природы реагирующих веществ и условий, в которых протекает реакция: температура и наличие катализатора, но не зависит от концентрации реагирующих веществ.
Влияние катализаторов на скорость реакции
Одно из наиболее сильных средств влияния на скорость реакции – присутствие в реагирующей системе катализатора. Катализатором называют вещество, вступающее в реакцию и увеличивающее ее скорость, но остающееся неизменным по окончании реакции.
Увеличение скорости реакции в присутствии катализатора называют катализом. Когда реагенты и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагенты и катализатор находятся в разных агрегатных состояниях: обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы (пример гетерогенного катализатора – оксид ванадия (V) в промышленном технологическом процессе окисления SO2 в SO3).
Механизмы каталитических процессов очень сложные, однако они имеют общие черты. Основная гипотеза, объясняющая катализ, – предположение об образовании промежуточных продуктов при взаимодействии катализатора и исходного вещества.
Рассмотрим реакцию без катализатора A + B = AB, которая протекает медленно. При добавлении катализатора K он реагирует с одним из исходных веществ, образуя непрочное и очень реакционноспособное промежуточное соединение AK (или BK): A + K = AK (или B + K = BK).
Промежуточное соединение AK взаимодействует с исходным веществом B, образуя конечный продукт реакции AB и освобождая катализатор K в первоначальном виде: AK + B = AB + K.
Простая схема катализа показывает почему катализатор может принимать участие в реакции «бесчисленное» множество раз. Правда, это только теоретически, потому что на практике в реакционной среде могут присутствовать вещества (даже в малых количествах), уменьшающие или полностью уничтожающие активность катализатора. Такие вещества называют каталитическими ядами, а снижение активности катализатора под действием этих вредных веществ – отравлением катализатора.
Механизм действия катализатора заключается в том, что катализатор изменяет путь от реагентов к продуктам, причем новый «маршрут» характеризуется меньшей высотой энергетического барьера, т. е. меньшей энергией активации по сравнению с энергией активации некатализируемой реакции.
2)Энергия активации.
Энергией активации реакции называется минимальная энергия (в расчете на 1 моль), которой должны обладать р еагирующие частицы, чтобы столкновение между ними привело к реакции.

Энергия активации зависит от:
- природы реагирующих веществ.
- наличия катализатора
Энергия активации не зависит от:
- температуры
- скорости элементарной химической реакции.
3) Энергия активации уменьшается при введении катализатора.
В присутствии катализатора снижается энергия активации — механизм реакции изменяется и она протекает по другому пути, энергетически более выгодному. Этим и объясняется увеличение скорости реакции под влиянием катализатора.
Так как в выражении для константы скорости реакции энергия активации входит в отрицательный показатель степени, то даже небольшое изменение энергии активации вызывает очень большое увеличение скорости реакции.
Дополнительная информация по теме
Увеличение скорости реакции можно объяснить учащением столкновений молекул вследствие увеличения их скорости движения с повышением температуры.
Разъясняет действие этой другой причины теория активации, согласно которой во взаимодействие вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества. Для активации остальных молекул им необходимо придать дополнительную энергию, что и может быть достигнуто повышением температуры.
Энергия, которую надо придать молекулам реагирующих веществ, для того, чтобы сделать их активными, называется энергией активации. Она зависит от природы реагирующих веществ и является характеристикой любой реакции и обычно выражается в кДж/моль. Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция.
Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит.
Отрицательные катализаторы – ингибиторы, которые отличаются от катализаторов тем, что входят в состав продуктов реакции
