

|
|
|
|
Исправление Лабораторной работы №4. |
|
|
|||||
1) Изменены единицы измерения концентрации на графике: |
|
||||||||||
|
|
4,5 |
|
|
|
|
|
|
|
|
|
|
реакции |
4 |
|
|
|
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скорость |
3 |
|
|
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Относительная |
2 |
|
|
|
|
|
|
|
|
|
|
1,5 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
|
|
|
|
|
Концентрация, моль/мл |
|
|
|
||
2) Изменены линии аппроксимации: |
|
|
|
|
|
||||||
реаакции |
4 |
|
|
|
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скорость |
2,5 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Относительная |
1,5 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
10 |
|
20 |
30 |
|
40 |
50 |
|
|
|
|
|
|
|
Температура, °С |
|
|
|
|
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии
ОТЧЕТ
по лабораторной работе №4 по дисциплине «Химия»
Тема: Скорость химических реакций
Студент гр. 1282 |
|
Козлов С.В. |
|
Преподаватель |
|
Рубцов Э.Р. |
|
|
|||
|
|
|
|
Санкт-Петербург
2021
1
Цель работы: Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
Основные теоретические положения
Согласно закону действия масс, при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени,
равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции. Например, скорость v реакции (mА + nB)
записывается следующим образом: = [ ] [ ] , где k - константа скорости реакции, зависящая от природы реагирующих веществ и температуры; [A], [B] - концентрации реагирующих веществ, моль * л-1; m, n - стехиометрические коэффициенты.
Скорость химической реакции зависит от: природы реагирующих веществ,
концентрации реагентов, площади соприкосновения реагирующих веществ,
температуры, наличия катализатора.
Зависимость скорости химической реакции от концентрации исходных веществ определяется законом действующих масс: скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
1 1 + 2 2 + 3 3 →
Константой скорости химической реакции называется коэффициент пропорциональности k (её физический смысл: численно равна скорости реакции при концентрации каждого из реагирующих веществ, равной 1 моль/л
2
или в случае порядков реакции по каждому реагенту, равных 0), и она зависит от температуры, от природы реагирующих веществ, от катализатора.
Скорость химической реакции от температуры и описывается правилом Вант-
Гоффа: при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
2− 1
2 = 1 10
Физический смысл температурного коэффициента γ - отвечает за увеличение скорости реакции. Если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов.
Зависимость константы скорости k от температуры T описывается основным законом химической кинетики – уравнением Аррениуса:
ln |
= |
|
|
|
|
|
2 |
Энергия активации химической реакции – это эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры.
Энергия активации химической реакции зависит от температуры и не зависит от скорости элементарной химической реакции.
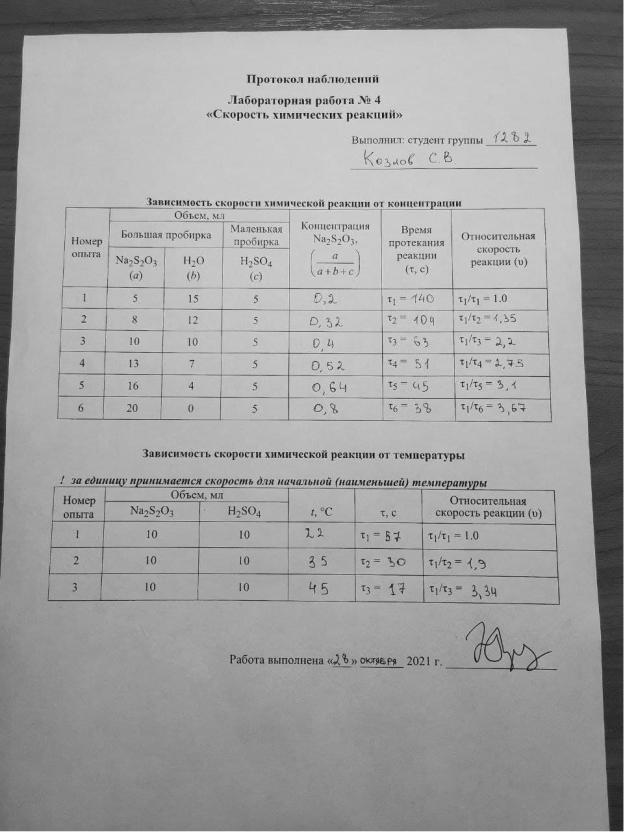
В лабораторной работе для исследования зависимости скорости реакции от концентрации и температуры используется реакция взаимодействия серной кислоты и тиосульфата натрия. Эта реакция протекает в две стадии.
1) Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4
3
2) H2S2O3 = H2O + SO2↑ + S↓
Экспериментально доказано, что первая стадия протекает с большой скоростью. Скорость всей реакции в целом определяется скоростью второй
(медленной) стадии в соответствии с ν= k[H2S2O3].
Поскольку концентрация H2S2O3 в растворе прямо пропорциональна концентрации Na2S2O3, скорость реакции можно рассматривать как ν = k[Na2S2O3].
4
5

|
|
|
|
Обработка результатов |
|
|
|
|||
1. Зависимость скорости химической реакции от концентрации |
||||||||||
График зависимости относительной скорости химической реакции от |
||||||||||
концентрации 2 2 3: |
|
|
|
|
|
|
||||
|
4 |
|
|
|
|
|
|
|
|
|
реакции |
3,5 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скорость |
2,5 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Относительная |
1,5 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
|
|
|
|
Концентрация, моль/л |
|
|
|
|
|
2. Зависимость скорости химической реакции от температуры |
||||||||||
График зависимости относительной скорости химической реакции от
температуры:
Относительная скорость реакции
5
4,5
4
3,5
3
2,5
2
1,5
1
0,5
0
0 |
10 |
20 |
30 |
40 |
50 |
60 |
Температура, С
6

2− 1
На основании правила Вант-Гоффа: 1 = 2 10 , выразим и рассчитаем температурный коэффициент γ для трех пар:
|
|
|
|
10 |
|
|
1,9 |
10 |
|
|
||||||||
|
= ( |
2 |
) |
|
|
= ( |
|
) |
|
|
= 1,706 |
|||||||
2− 1 |
35−23 |
|||||||||||||||||
|
|
|
||||||||||||||||
12 |
|
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
10 |
|
|
3,34 |
10 |
|
|
|||||||||
|
= ( |
3 |
) |
|
|
= ( |
|
|
|
) |
|
= 1,759 |
||||||
3− 2 |
|
|
|
45−35 |
||||||||||||||
|
|
|
|
|||||||||||||||
23 |
|
|
|
|
|
|
|
1,9 |
|
|
|
|
|
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
10 |
|
|
3,34 |
10 |
|
|
|||||||||
|
= ( |
3 |
) |
|
|
= ( |
|
|
|
) |
|
= 1,730 |
||||||
3− 1 |
|
|
|
45−23 |
||||||||||||||
|
|
|
|
|||||||||||||||
31 |
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1 2 ln( 2)
На основании формулы 1 рассчитаем энергию активации реакции
2− 1
для трех пар температур.
|
|
|
|
|
|
ln( |
2 |
) |
|
|
8,31 × 295 × 308 × ln( 1,9) |
|
||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
1 |
2 |
|
|
1 |
|
|
|
|
|
1,0 |
|
|
|
|
|
|||||
|
|
= |
|
|
|
|
|
|
= |
|
|
|
|
|
|
= 37,279 кдж/моль |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
12 |
|
|
|
2 − 1 |
|
|
|
|
|
|
|
|
308 − 295 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
ln( |
3 |
) 8,31 × 318 × 308 × ln( |
3,34 |
) |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
2 |
3 |
2 |
|
|
|
|
|
|
|
|
|
1,9 |
|
|
|
|
|
|||
|
= |
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
= 45,914 кдж/моль |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
23 |
|
|
|
|
3 − 2 |
|
|
|
|
|
|
|
|
318 − 308 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
ln( |
|
3 |
) |
|
|
|
8,31 × 318 × 295 × ln( |
3,34 |
) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
3 |
1 |
|
1 |
|
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|||
|
|
= |
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
= 40,875 кдж/моль |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
31 |
|
|
|
|
3 − 1 |
|
|
|
|
|
|
|
|
318 − 295 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Выводы: Скорость химической реакции зависит от концентрации веществ, а
также зависит от температуры опыта, зависимость от которой описано правилом Вант-Гоффа. По закону действующих масс скорость химической реакции пропорциональна произведению концентраций реагентов в
7

степенях, равных стехиометрическим коэффициентам в уравнении реакции.
В нашем случае зависимость прямо пропорциональна с небольшими отклонениями, обусловленными человеческим фактором. Зависимость относительной скорости реакции от концентрации хорошо видна на графике.
Согласно правилу Вант-Гоффа, скорость большинства гомогенных реакций при повышении температуры на 10 ˚C увеличивается в 2-4 раза:
1 = 2 − 12 10
В данном опыте правило Вант-Гоффа не соблюдается, так как на опыт могло влиять множество факторов. Например, сложно было точно и моментально определить помутнение раствора, возможно было остывание раствора в процессе перемешивания. В опыте относительная скорость реакции возросла в 1,66 раз при повышении температуры на 10˚C.
8
