
Аналитическая химия и физико-химические методы анализа / Контрольная работа - Задание 1 и 2
.docxНомер варианта |
Вещество |
Масса вещества, г |
Объём раствора, см3 |
15 |
NH2OH |
0,4954 |
300 |
Фекличева А.С. ЗОС-21
Задача 1. Рассчитайте равновесную концентрацию ионов [H3O+] и pH раствора, содержащего указанное количество вещества в данном объёме раствора.

Задача 2. Напишите уравнение реакции переноса протона в водном растворе данного протолита. Найдите значение константы равновесия и рассчитайте равновесную концентрацию ионов водорода [H3O+].
Номер варианта |
Протолит |
Молярная концентрация протолита, моль/дм3 |
15 |
NaCN |
0,50 |
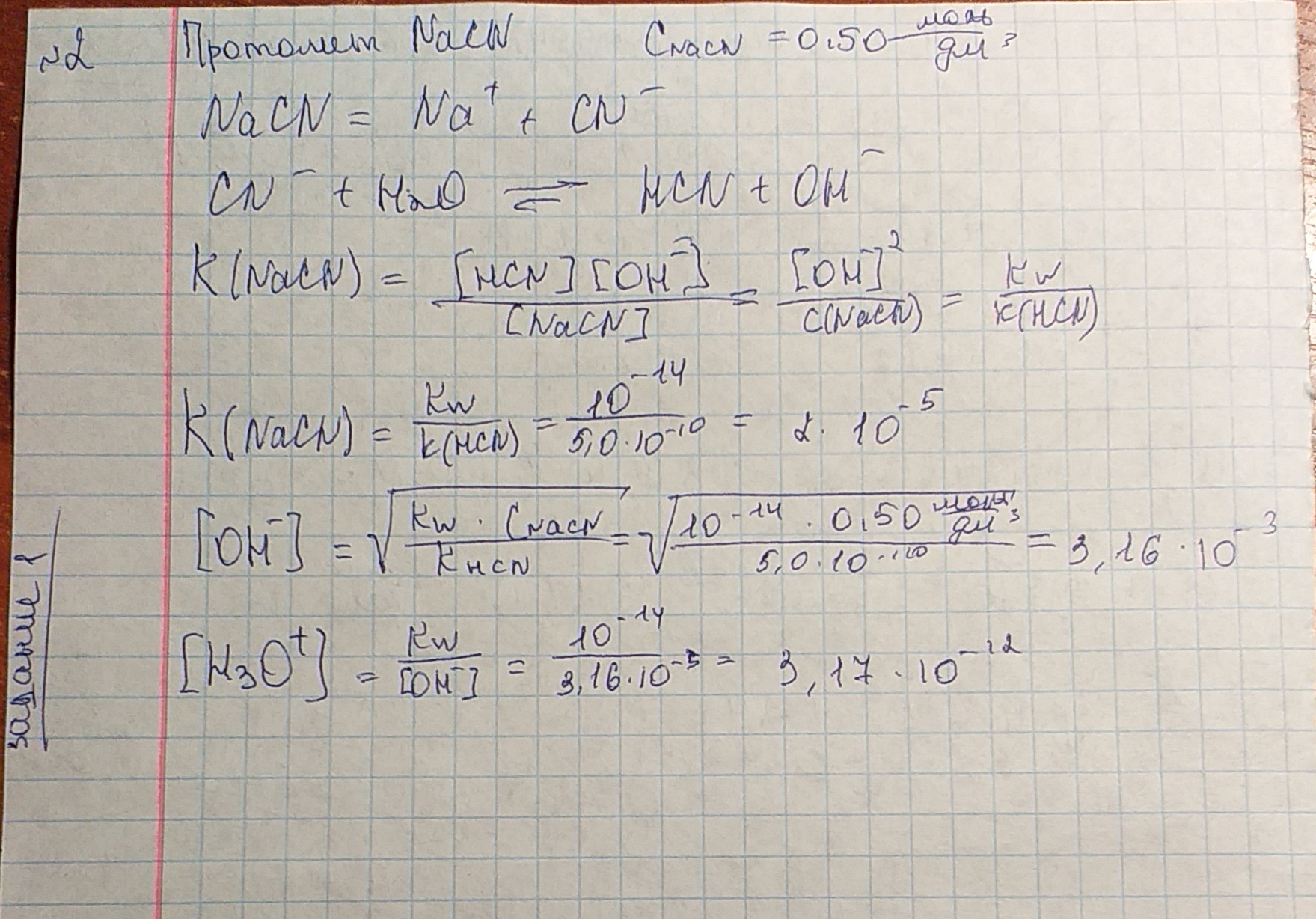
Номер варианта |
Исходный протолит |
Формула соли |
pH буферного раствора |
|
15 |
Формула |
Молярная концентрация, моль/дм3 |
|
В |
HCOOH |
0,55 |
HCOOK |
5,00 |
|
Задача 3. Сколько граммов соли необходимо растворить в 1 дм3 исходного раствора протолита, чтобы получить буферный раствор с заданным значением рН.
Задача 1. По данным вашего варианта вычислите молярную концентрацию и титр раствора.
Номер варианта |
Дано |
Вычислить |
||
5 |
Т(Х), Т(R/Х), г/cм3 |
В |
С(Х), моль/дм3 |
Т(Х), Т(R/Х), г/cм3 |
T(HCLO4/KOH) |
0,002540 |
C(HCLO4) |
T(HCLO4) |
|

Задача 2. Какой объем раствора I (см3) с известной концентрацией надо добавить к 1 дм3 раствора II этого же вещества с определённой массовой концентрацией ω и плотностью ρ, чтобы получить раствор III с заданной молярной концентрацией эквивалента?
Номер варианта |
Раствор I |
Раствор II |
Молярная концентрация раствора III, моль/дм3 |
|
5 |
Т(Х), Т(R/Х), г/cм3 |
ω, % |
ρ, г/см3 |
В |
T(KOH/HCL) = 0,05870 |
0,280 |
1,000 |
0,09430 |
|

Задача 3. Рассчитайте массовую долю ω, % определяемого вещества в техническом продукте, если известно, что на титрование его навески затрачивается VТ, см3 титранта.
Номер варианта |
Определяемое вещество |
Навес ка, г |
VТ, см3 |
Концентрация титранта |
в |
||||
5 |
H3PO4 по МО** |
0,7210 |
20,10 |
T(KOH) = 0,003887 |

Задача 4. Для определения содержания металла в сплаве навеску сплава растворили в соляной кислоте. Далее катион металла осадили в виде гидроксида. Осадок растворили в 50 см3 HCl с молярной концентрацией 0,1 моль/дм3 (К = 0,9980). На обратное титрование с метиловым оранжевым израсходовали определённое количество раствора титранта известной концентрации. Определить массовую долю металла в сплаве (ω, %).
Номер варианта |
Металл |
Навеска, г |
Объём титранта,см3 |
Концентрация титранта |
в |
||||
5 |
Fe(II) |
0,2860 |
21,30 |
T(NaOH/HCL) = = 0,003471 |

