
44_савицький
.pdf
Міністерство освіти і науки України Національний університет „Львівська політехніка”
Кафедра фізики Оптична лабораторія
Звіт з лабораторної роботи №44
на тему: “Визначення сталої Планка по спектральних лініях водню”
Виконав: ст.гр.КІ-105 Cавицький С.В. Прийняв:
Ільчук Г. А.
Львів – 2025

Мета роботи – Експериментально дослідити видиму частину спектра випромінювання атомів водню, за результатами вимірювань розрахувати сталу Планка.
Прилади і матеріали: 1)монохроматор УМ-2 /або спектроскоп/; 2)прилад СПЕКТР-1 із спектральними трубками водню, гелію; 3)неонова лампа на штативі.
Теоретичні відомості
Як відомо спектр кожного газу складається з окремих спектральних ліній або груп (серій) близько розташованих ліній. Найбільш вивченим є спектр атома водню. Частоти випромінювання
атома водню можна описати узагальненою формулою Бальмера у вигляді (4.4) (див. §4.1): |
|
||||||||
|
|
|
1 |
|
1 |
|
|
||
ν |
kn |
= R |
|
|
− |
|
|
|
|
|
2 |
|
2 |
|
|||||
|
|
|
|
k |
|
(1) |
|||
|
|
n |
|
|
|
, |
|||
де ν kn − частота випромінювання атома водню при його переході з k −го енергетичного рівня на n
−й енергетичний рівень; R − стала Рідберга; k і n − цілі числа ( n = 1,2,3,... , а k |
набуває значень |
|
||
n +1, n + 2 і т.д.). |
|
|
|
|
Стала Рідберга R у формулі (1) визначається співвідношенням (4.7) (див. §4.1) |
|
|||
|
|
R = |
Z 2 me e4 |
|
|
|
8h3ε o2 |
, |
|
|
|
|
||
де Z − порядковий номер атома (для атома водню |
Z =1); m=9,11·10-31 кг |
(2) |
||
– маса електрона; |
|
|||
е=1,6·10-19 Кл – заряд електрона; |
ε0 =8,85·10-12 Ф/м – електрична стала; с =3·108 |
м/с – швидкість |
||||||||||||||||||||||||||||||
світла у вакуумі; h − стала Планка. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Кожному значенню |
n |
в (1) відповідає серія спектральних ліній. Для видимої частини |
||||||||||||||||||||||||||||||
спектра атома водню n =2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Формулу (1) з урахуванням (2) можна записати таким чином: |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Z 2m e4 |
|
|
|
1 |
|
|
|
|
1 |
|
|
|||||||||||
|
|
|
|
ν kn |
= |
|
|
e |
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
8h3εo2 |
|
|
|
|
|
k 2 |
|
|
|||||||||||||||||||
|
|
|
c |
|
|
|
|
|
|
|
|
n2 |
|
|
. |
|
(3) |
|||||||||||||||
λ |
kn |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Враховуючи, що |
ν kn |
з (3) одержуємо формулу для визначення сталої Планка: |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
m e4Z |
2λ |
|
|
1 |
|
|
|
|
1 |
|
|
|
||||||||||||||
|
|
|
|
h = 3 |
|
|
e |
|
kn |
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k 2 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
8ε02c |
|
|
22 |
|
|
|
|
|
. |
(4) |
||||||||||||
З врахуванням того, що для атома водню Z =1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
вираз (4) перепишемо у вигляді |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
m e4λ |
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||||||||||
|
|
|
|
h = 3 |
|
|
|
e |
kn |
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
k 2 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
8ε02c |
22 |
|
|
|
|
|
. |
|
|
(5) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Перехід атомів газу із основного стану в збуджений легко здійснити за допомогою електричного розряду в розрідженому газі. Перехід атомів із збудженого стану в основний відбувається спонтанно (самовільно) з випромінюванням ліній усіх серій.
В даній лабораторній роботі визначають наступні лінії в спектрі випромінювання водню, які лежать у видимій частині спектру:
•червону лінію Hα (λ3,2 ), ( k =3);
•зелено-голубу лінію Hβ (λ4,2 ), ( k =4);
2
•фіолетово − синю лінію Hγ (λ5,2 ), ( k =5);
•фіолетову лінію Hδ (λ6,2 ) , ( k =6).у
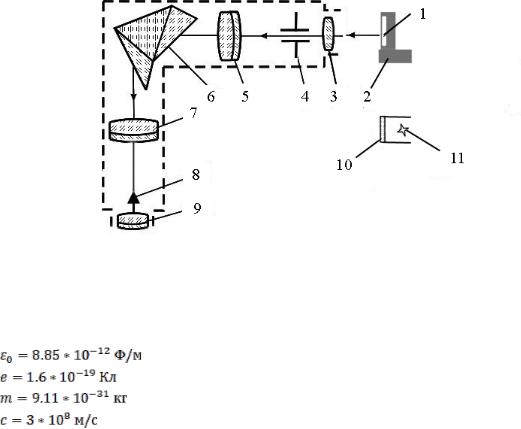
Експериментальна установка зібрана на основі монохроматора УМ–2, який використовується як спектроскоп. Оптична схема установки наведена на рис. 1.
Рис. 1
1 − воднева газорозрядна трубка; 2 − блок живлення трубки; 3 – збиральна лінза; 4 − вхідна щілина;
5 − об’єктив коліматора; 6 − дисперсійна призма; 7 − об’єктив зорової труби; 8 − візир; 9 − окуляр; 10 – захисний кожух неонової лампочки; 11 − неонова лампочка.
Данні сталі:
Таблиці результатів вимірювань:
Таблиця 1
λ, Å |
4100 |
4340 |
4500 |
4860 |
5200 |
5540 |
5860 |
6230 |
6560 |
|
|
|
|
|
|
|
|
|
|
n, відн. од. |
940 |
1210 |
1370 |
1820 |
2040 |
2340 |
2550 |
2710 |
2820 |
|
|
|
|
|
|
|
|
|
|
3

Таблиця 2
Колір і індекс лінії |
n, |
λ, |
Квантові числа |
|
h·1034, |
h·1034, |
δh, 100% |
||
|
відн.од. |
Å |
|
|
|
|
Дж·с |
Дж·с |
|
|
|
n |
k |
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Яскраво−червона, |
2820 |
6560 |
|
2 |
3 |
6.63 |
0 |
|
|
Hα |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зелено−голуба, |
1820 |
4860 |
|
2 |
4 |
6.62 |
0.01 |
|
|
Hβ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фіолетово−синя, |
1210 |
4340 |
|
2 |
5 |
6.67 |
0.04 |
|
|
Hγ. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фіолетова, |
940 |
4100 |
|
2 |
6 |
6.7 |
0.07 |
|
|
Hδ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сер. |
1690 |
4965 |
|
2 |
4.5 |
6.655 |
0.03 |
|
|
|
|
|
|
|
|
|
|
|
|
Обчислення:
Висновок:
У ході виконання лабораторної роботи було експериментально досліджено спектральні лінії водню у видимій частині спектра. За допомогою монохроматора УМ–2 були визначені довжини хвиль для чотирьох характерних ліній серії Бальмера: Hα (червона), Hβ (зелено-голуба), Hγ (фіолетово-синя) та Hδ (фіолетова).
Отримані значення для кожної лінії відрізнялися не більше ніж на 7–8% від табличного значення, що свідчить про достатню точність проведених вимірювань та розрахунків. Середнє експериментальне значення сталої Планка склало:
 .
.
4
