
- •11. Основания. Основные химические свойства. Способы их получения.
- •13. Образование химической связи. Энергия и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •14. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
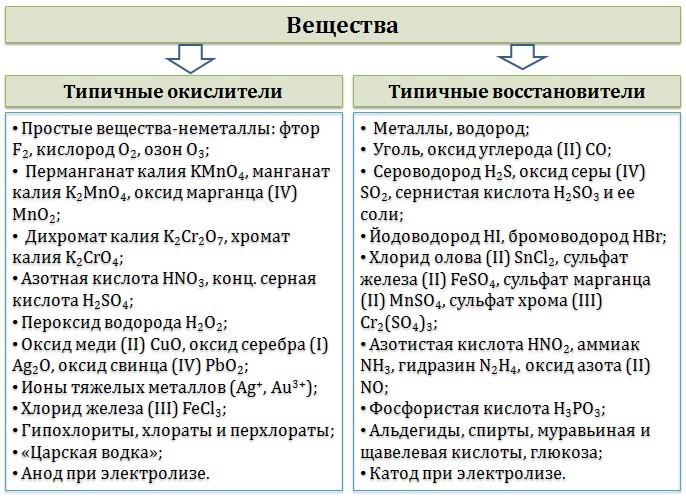
- •15. Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Ионно-электронный метод.
- •Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
14. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
Ковалентная связь (атомная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков.
Особенностями ковалентной химической связи являются ее направленность и насыщаемость.
Количественно направленность выражается в виде валентных углов между направлениями хим. связи в молекулах и твердых телах.
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут учувствовать в образовании ковалентной связи.
Метод валентных связей
Основные положения:
1. Химическая связь между атомами возникает как результат перекрывания АО (атомные орбитали) с образованием электронных пар (обобществление двух элетронов).
2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами
3. При образовании химической связи происходит частичное перекрывание атомных орбиталей (АО), что приводит к увеличению электронной плотности в межъядерном пространстве
4. Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО
5. В пространстве химическая связь располагается в том направлении, в котором возможность перекрывания АО наибольшая
6. Связь, образованная перекрыванием АО по линии, соединяющей центры атомов, называется σ-связью, а по обе стороны от линии – π-связью. Еσ > Еπ
7. Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью,
а кратные связи включают σ- и π-связи
8. Общая электронная пара соответствует единице химической связи
Межмолекулярное взаимодействие – взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей.
В
их основе, как и в основе химической
связи, лежат электрические  взаимодействия.
взаимодействия.
Ван-дер-Ваальсова связь – наиболее универсальный вид
межмолекулярного и межатомного взаимодействия,
возникающий при поляризации молекул
и образовании диполей
Eсв = 2–20 кДж/моль
ВОЗБУЖДЁННЫЕ СОСТОЯНИЯ АТОМОВ
Состояние атома, при котором его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными.
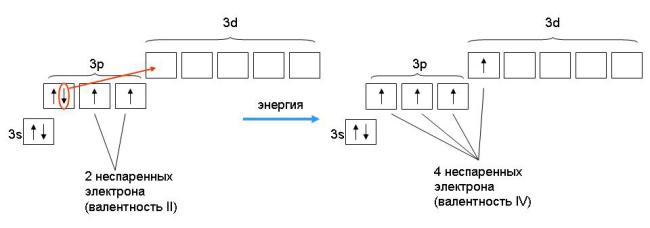
При сообщении атому дополнительной энергии электроны могут переходить на обладающие большей энергией орбитали. Эти переходы с подуровня на подуровень возможны только в пределах одного внешнего энергетического уровня. Происходящее при этом распаривание электронов приводит к возрастанию у атома числа неспаренных электронов, т.е. к появлению новых валентных возможностей.
15. Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Ионно-электронный метод.
Валетность – это способность атома присоединять или замещать определенное число других атомов с образованием хим. связи.
Валентность химического элемента определяет сколько одинарных химических связей способны образовывать атомы этого элемента с другими атомами.
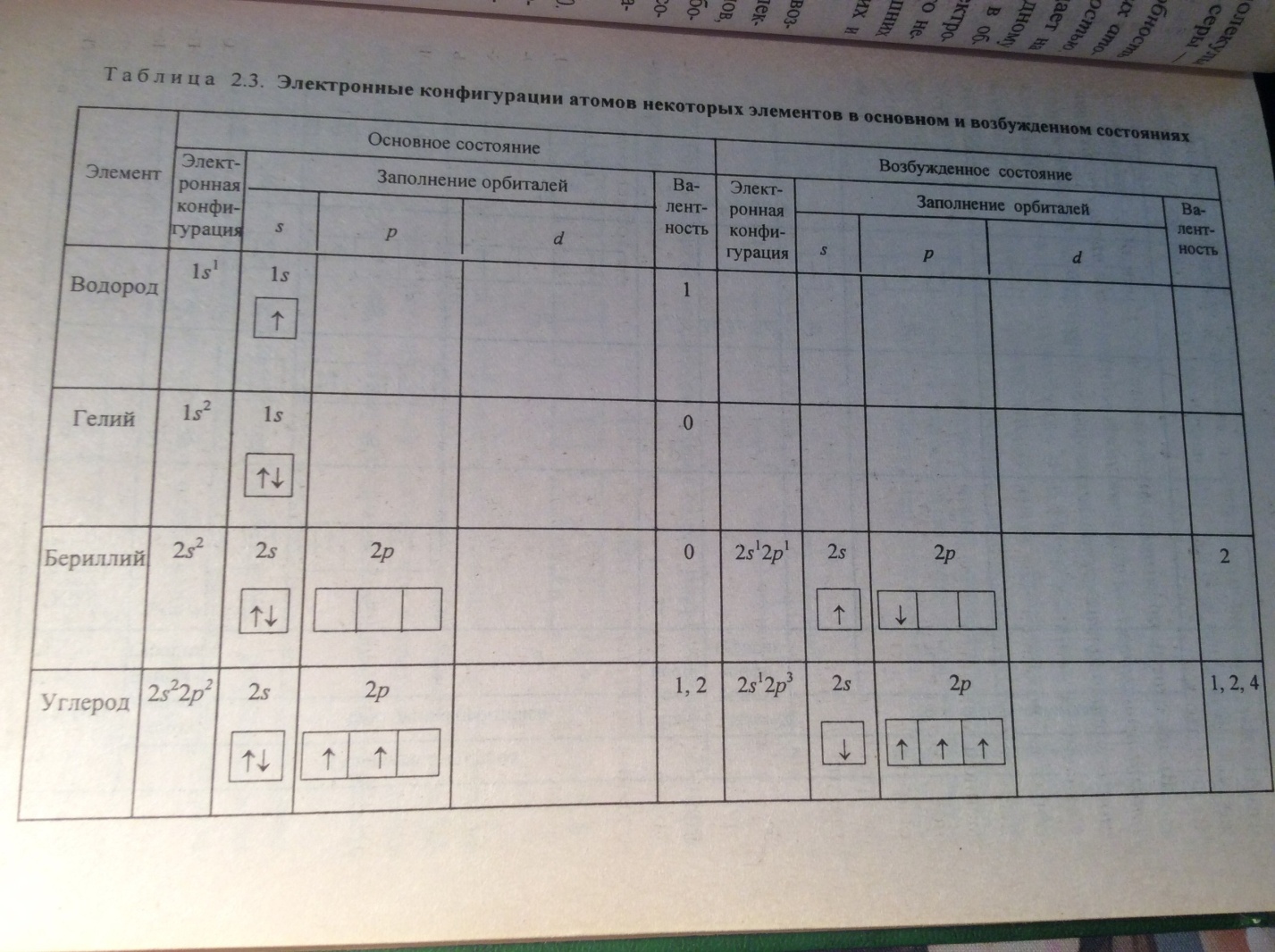
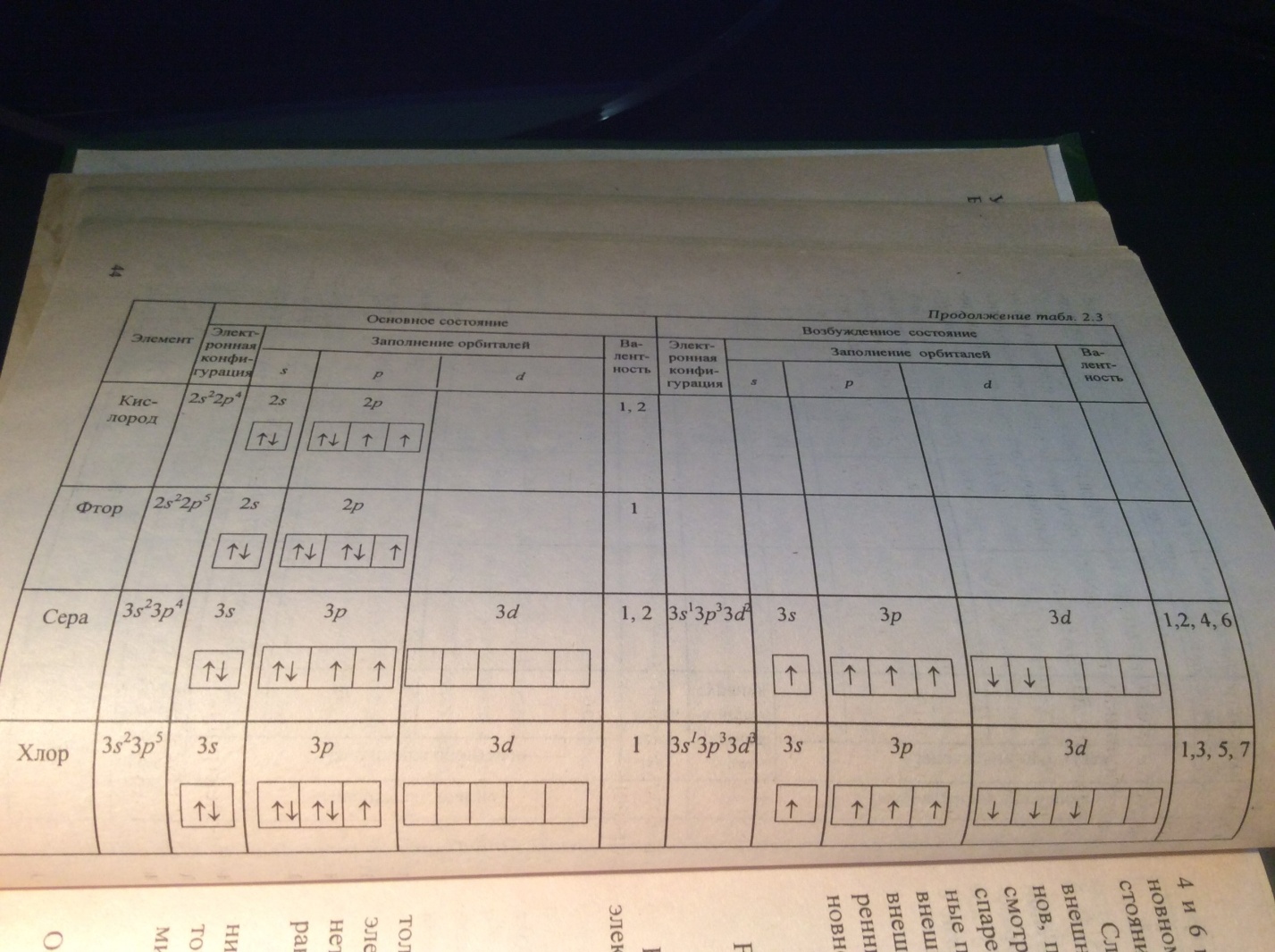
Согласно обменному механизму метода Валентных связей (ВС) каждый атом отдает на образование общей электронной пары (ков. св.) по одном не спаренному электрону.
Количественная мера в этом механизме является число неспаренных электронов у атома в основном или возбужденных состояниях атома.
При возбужденном состоянии происходит распаривание элетронных пар, распаренный электрон занимает свободную орбиталь.
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится.
Однако обычно атом проявляет валентность, равную количеству его неспаренных электронов. Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Степень окисления, по сравнению с валентностью, более универсальное понятие. Оно не зависит от вида химической связи и является характеристикой для соединений как с ковалентной, так и ионной и металлической связью. Степень окисления — это условный заряд на атоме в веществе. При определении степени окисления делают предположение, что все связи в соединении ионные. Степень окисления может быть положительной, отрицательной, нулевой.
Поскольку металлы обычно образуют ионные связи неметаллами, то под их валентность понимают именно степень окисления.
В простых веществах степень окисления атомов считают равной нулю. Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле H2 валентность атомов равна I, а степень окисления 0.
Отрицательную степень окисления имеют атомы с большей электроотрицательностью. Так в хлориде калия K+1Cl-1 электронная пара смещена к хлору.
При определении степеней окисления атомов в молекуле следует иметь в виду, что сумма степеней окисления должна быть равна нулю, так как молекула электронейтральна.

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления. При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы: H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
Запишем уравнение в ионном виде, сократив те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
