
- •11. Основания. Основные химические свойства. Способы их получения.
- •13. Образование химической связи. Энергия и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •14. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •15. Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Ионно-электронный метод.
- •Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
11. Основания. Основные химические свойства. Способы их получения.
Основания - сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп –OH– .
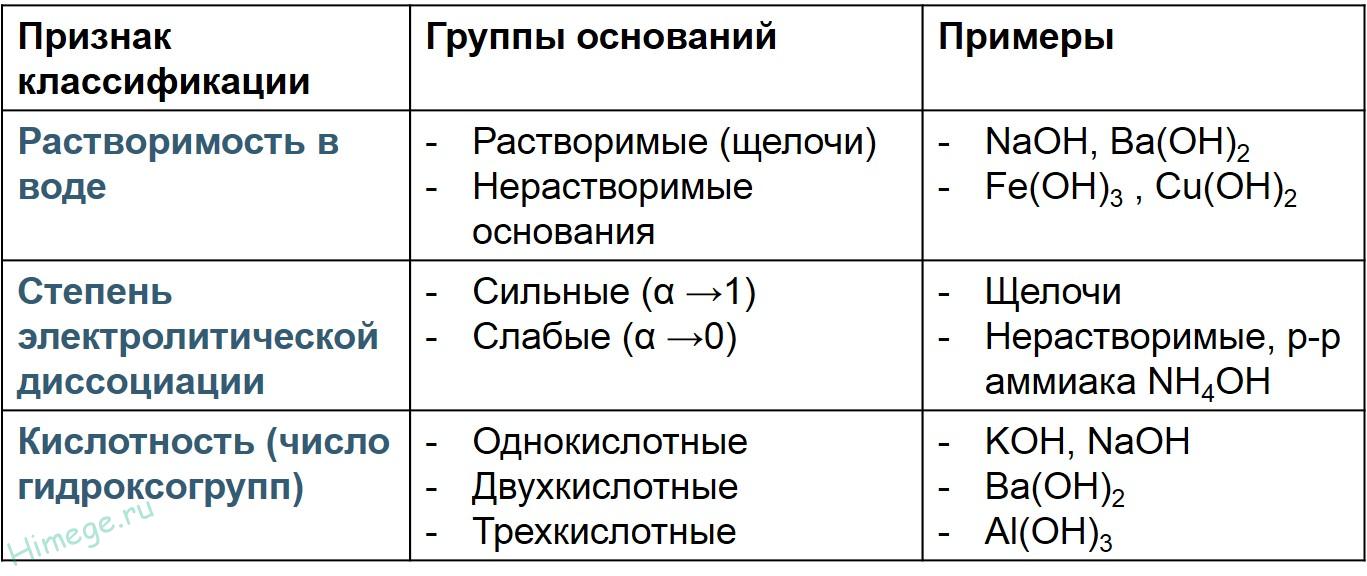
В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
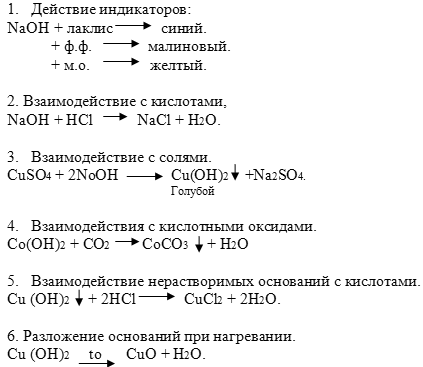
Химические свойства:
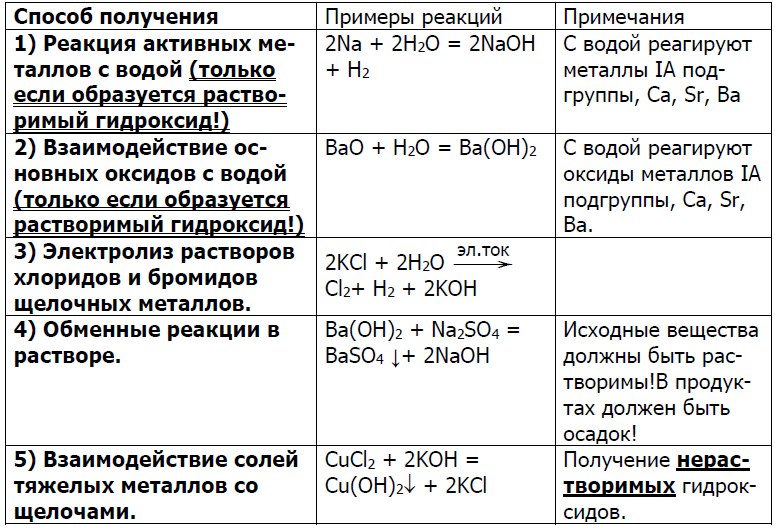
Способы получения:
12. Соли.Основные химические свойства. Соли — это химические соединения, которые в водных растворах диссоциируют с образованием катиона металла (или NH4+) и анионов кислотного остатка.
Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
Растворимые соли взаимодействуют со щелочами , если одно из образующихся веществ выпадает в осадок
Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой
При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т.к. в реакции участвует вода из раствора
Растворы солей реагируют между собой, если происходит связывание ионов. Если связывания ионов нет, то реакция идёт не до конца
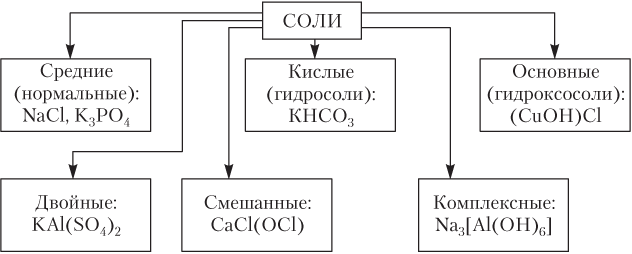
Соли делятся на:
Кислые (Продукты неполного замещения атомов водорода на металл, кислые соли могут образовывать только 2-х или многоосновные кислоты)
NaHCO3,MgHSO4
Средние (Продукты полного замещения атомов водорода на металл).
Основные (Соли, которые кроме ионов металла и кислотного остатка содержат гидроксо-группы).
Аl(ОН)2Сl,[Са(ОН)]2СО3
Также соли делятся на: Двойные (соли, в которых атомы водорода многоосновной кислоты замещены разными металлами(KNaSO4)), смешанные(CaClBr) и комплексные.
Способы получения солей
Взаимодействия кислот и оснований:
KOH + HCl → KCl + H2O
Взаимодействия кислот с основными оксидами:
H2SO4 + CuO → CuSO4 + Н2O
Взаимодействия щелочей с кислотными оксидами:
2NaOH + SiO2 → Na2SiO3 + H2O
Взаимодействия кислотных и щелочных оксидов:
Na2O + CO2 → Na2CO3
Взаимодействия простых веществ:
2K + Cl2 → 2KCl
При неполной нейтрализации кислоты основанием образуется кислая соль:
H2SO4 + NaOH = NaHSO4 + H2O
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами (+способ получения) с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями (+способ получения), образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом (+способ получения) с образованием новых солей:
NaCl + AgNO3 →AgCl + NaNO3 .
5. Взаимодействуют с металлами (+способ получения), которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
