
- •6. Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •7. Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер. Электронные аналоги.
- •8.Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Оксиды. Основные химические свойства. Способы их получения.
- •Способы получения:
- •10. Кислоты. Основные химические свойства. Способы их получения.
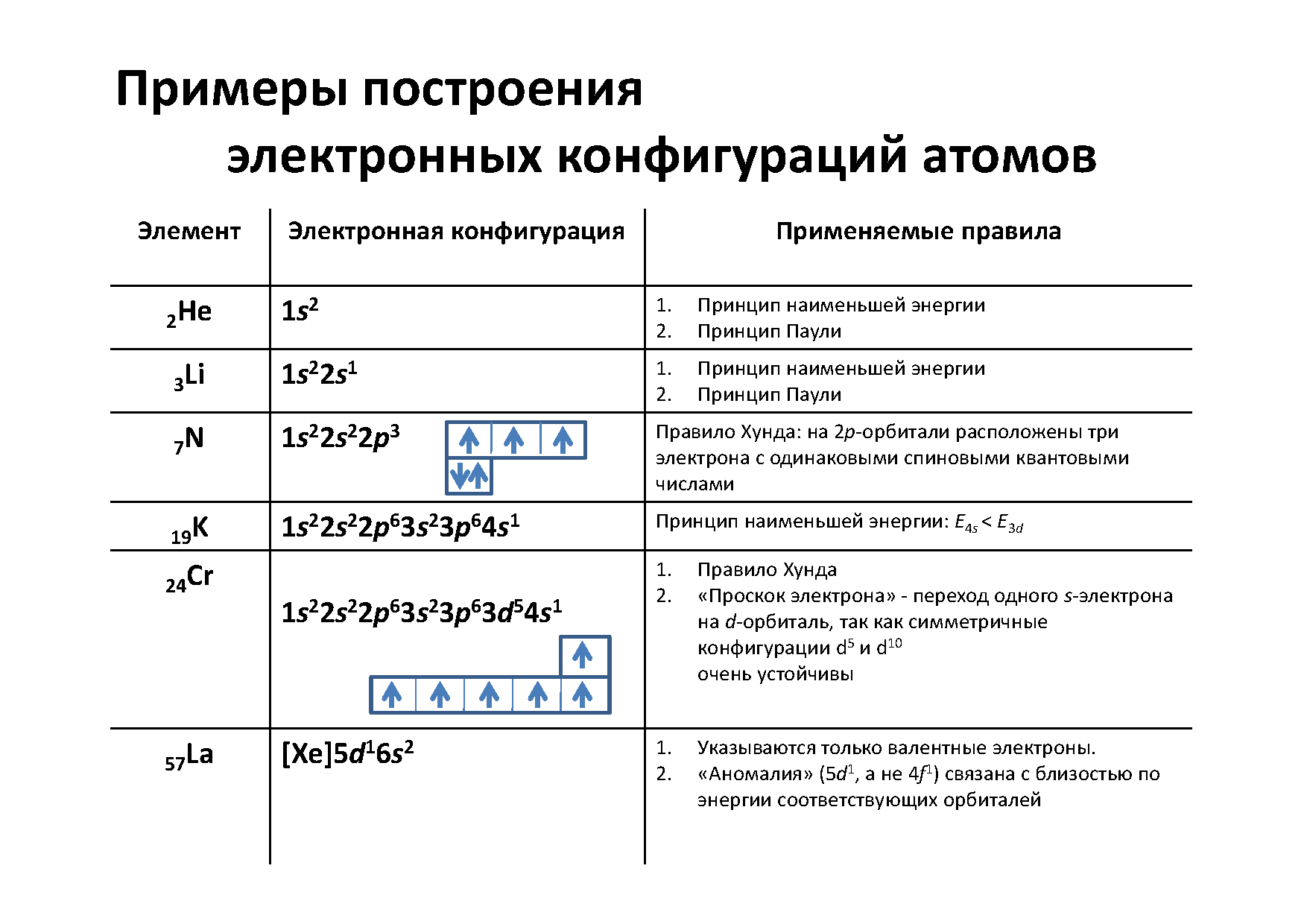
6. Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
Электроны заполняют при застройке оболочек наиболее выгодные в энергетическом отношении подуровни.
Принцип наименьшей энергии: В многоэлектронном атоме стабильной является такая конфигурация, для которой достигается минимум полной энергии. В первую очередь заполняются орбитали с наименьшей энергией, т.е. выполняется последовательность:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<6d<5f
Правило Клечковского: Энергия орбиталей увеличивается в порядке возрастания суммы квантовых чисел (n+l), а при одинаковой сумме этих чисел – в порядке возрастания главного квантового числа.
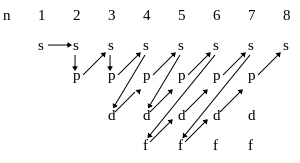
Таким образом, периодическая система полностью отражает прядок заполнения электронами энергетических уровней атомов любых элементов.
Электронная формула (конфигурация) атома химического элемента показывает расположение электронов на электронных оболочках (уровнях и подуровнях) в атоме или молекуле.
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Электронную формулу атома изображают следующим образом: каждому энергетическому уровню соответствует определенное главное квантовое число n, обозначаемое арабской цифрой; за каждой цифрой следует буква, соответствующая энергетическому подуровню и обозначающая орбитальное квантовое число. Верхний индекс у буквы показывает число электронов, находящихся в подуровне. Например, электронная формула атома натрия имеет следующий вид:
11Nа 1s22s22p63s1.
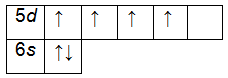
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
+74 W)2)8)18)32)12)2;
1s22s22p63s23p63d104s24p64f145s25p65d46s2.
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
7. Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер. Электронные аналоги.
После открытия периодического закона (1869) Д. И. Менделеев два года совершенствовал его формулировку и окончательно оформил её в следующем виде (1871):
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку:
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Периодическая система – классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона.
Период – последовательность атомов с одинаковым числом электронных слоев (одинаковое значение главного квантового числа). Большие периоды содержать 2 ряда (четный и нечетный). Периоды начинаются с активного металла, по мере продвижения усиливаются неметаллические свойства, а завершаются галогеном и инертным газом. Элементы, которые как бы осуществляют переход от металлов к неметаллам, носят название переходных.
Элементы группы проявляют одинаковую максимальную валентность по кислороду, равную номеру группы. Элементы главных подгрупп проявляют определенную валентность по водороду. В главных подгруппах по мере движения вниз металлические свойства усиливаются, побочных – ослабевают.
Порядковый номер соответствует заряду ядра атома элемента.
Химические элементы, у которых имеется одинаковая конфигурация валентных электронов, называются электронными аналогами.
У полных аналогов совпадают электронные конфигурации двух последних периодов.
Например: 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
50Sn: …………. 4s2 4p6 5s2 4d10 5p2
У неполных аналогов совпадают электронные конфигурации только последнего периода.
Например: 6C: 1s22s22p2
14Si: 1s2 2s2 2p6 3s2 3p6
Электронные аналоги, являющиеся химическими аналогами, характеризуются одинаковым количеством валентных электронов, которые участвуют в образовании химических связей
