
- •61. Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •62. Диаграмма состояния однокомпонентной системы на примере воды.
- •63.Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •64. Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •65. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
61. Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
Одним из наиболее распространенных видов физико-химического анализа является термический, который представляет собой совокупность экспериментальных методов определения температуры, при которой в равновесной системе изменяется число фаз. Термический анализ основан на наблюдении кривых охлаждения.
Кривые охлаждения – это графики зависимости изменения температуры от времени в данной системе. Если при охлаждении системы не происходит никаких фазовых превращений, то температура равномерно уменьшается. Если в системе происходит какое-либо превращение, сопровождающееся тепловым эффектом, то непрерывность хода кривой нарушается

Т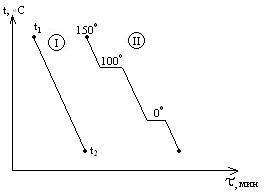
 ермографический
анализ
– кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается неизменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.
ермографический
анализ
– кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается неизменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.
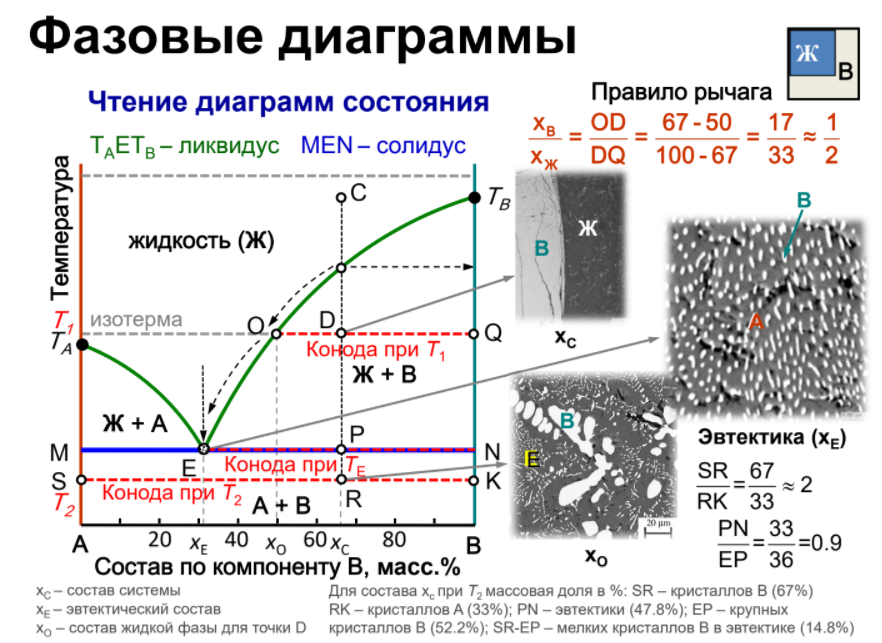
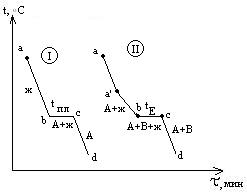
Рассмотрим кривые охлаждения чистого металла (I) и сплава с так называемой эвтектикой (II). На кривой охлаждения (I) чистого металла А наблюдается одна площадка bc, отвечающая процессу кристаллизации металла. При tпл в равновесии находятся жидкая и твердая фазы одинакового состава. Образование твердой фазы сопровождается выделением теплоты плавления.
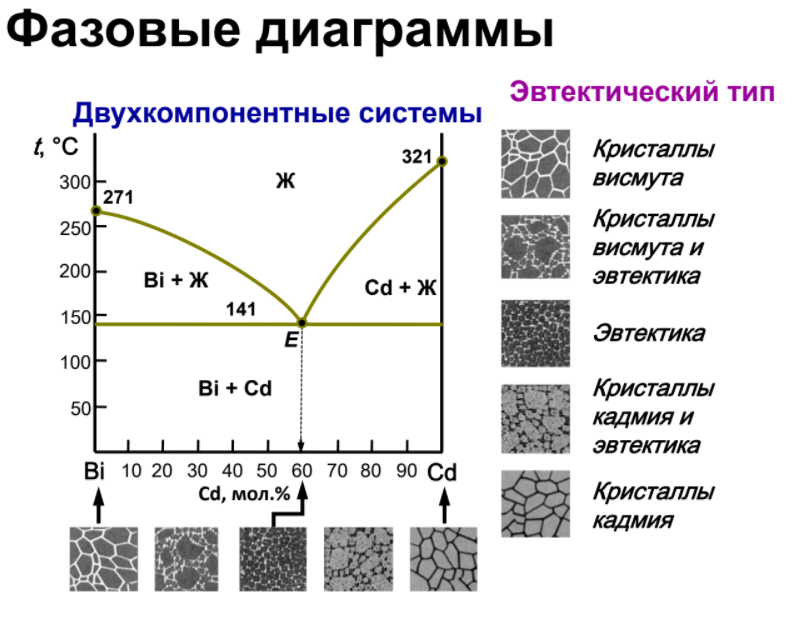
Кривая II отвечает охлаждению сплава А-В. От “а” до “a’ “ температура меняется монотонно, остывает жидкая фаза. При достижении точки a’ из жидкой фазы начинают выпадать кристаллы А – одного из компонентов сплава, при этом жидкая фаза за счет этого начнет обогащаться компонентом В. Таким образом, в интервале a’-b в равновесии находятся жидкая и твердая фазы различного состава, площадки на кривой охлаждения не наблюдается. За счет выделения при кристаллизации А теплоты плавления этого компонента темп охлаждения сплава замедляется, и на кривой наблюдается перелом. Выпадение кристаллов А продолжается до тех пор, пока жидкая фаза не достигнет так называемого “эвтектического состава”. Основной особенностью эвтектического сплава является то, что он кристаллизуется подобно чистому компоненту – на кривой охлаждения наблюдается площадка. Из жидкой фазы одновременно выпадают кристаллы А и В и, таким образом при tЕ (отрезок bc) в равновесии находятся жидкая и твердая фазы одинакового состава. Отрезок cd отвечают охлаждению твердого сплава.
Остановки в падении температуры могут наблюдаться и на кривой охлаждения уже твердого металла, указываю на переходы металла из одной аллотропной формы в другую.
Основные принципы построения диаграммы плавкости бинарных систем.
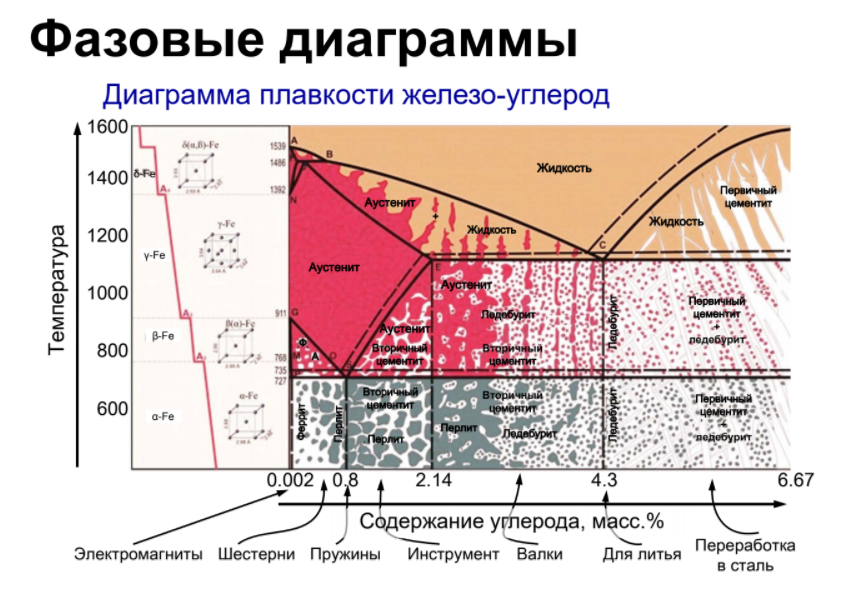
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
Диаграммы плавкости – частный вид диаграмм состояния.
Курнаков сформулировал 2 принципа, устанавливающих связь геометрических образов диаграммы с химическим состоянием системы.
