
53. Типы цепей.
Кроме электродов существуют цепи (концентрационные и альмагамные).
Концентрационная цепь.
Примечание автора. Обязательна графическая иллюстрация.
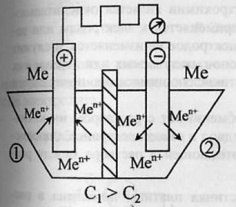
В сосуд помещены 2 одинаковых электрода и залиты раствором, содержащим ионы металла.
При замыкании цепи получают развитие процессы, приводящие к выравниванию концентрации всех растворов.
ЭДС
элемента:

Альмагамные цепи.
Альмагама – сплав металла со ртутью, остающийся жидким при комнатной температуре.
Примечание автора. Обязательна графическая иллюстрация.
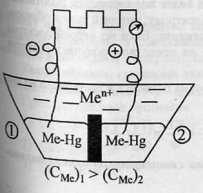
В сосуд залиты альмагамы с различной концентрацией металла и электролит, содержащий ионы металла.
При работе элемента: окисление в первом отделе, восстновление – во втором.
Процессы продолжаются до выравнивания концентраций электролитов и альмагам.
В принципе любой электрод окислительно-восстановительный, но этот термин применяется только в том случае, если материал электродов не изменяется, а служит лишь источником или приемником электронов.
Эти электроды, таким образом, обеспечивают отвод/подвод электронов.
Имеются таблицы стандартных окислительно-восстановительных потенциалов.
54. Электролиз. Последовательность разряда ионов на катоде и аноде.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом и т.д
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиз
Последовательность восстановления ионов на катоде зависит от:
концентрации ионов в растворе, чем больше концентрация ионов, тем легче они восстанавливаются;
активности металла, то есть от величины стандартного элек-тродного потенциала (j0), чем больше j0, тем менее активный металл, тем легче его ионы восстанавливаются.
от величины перенапряжения, возникающего при электролизе.
В зависимости от этих факторов электрохимический ряд напряжения по восстановительной способности ионов металла можно разделить на три группы:
1) катионы металлов от Li+ до Al3+ включительно не восстанавливаются из водных растворов, а вместо них восстанавливаются молекулы воды:
2Н2О + 2е– = Н2 + 2ОН– (рН ³ 7)
или
2Н+ + 2е– = Н2 (рН < 7).
Эти металлы могут быть получены электролизом их расплав-ленных солей, в которых ионы Н+ отсутствуют;
2) катионы металлов от Мn2+ до Н+ при электролизе восстанавливаются одновременно с водородом из-за явления перенапряжения:
Zn2 + 2e– = Zn0,
2H2O + 2e = H2+2OH– (pH > 7)
2H+ + 2e = H20 (pH< 7);
3) катионы металлов от Cu2+ до Au3+ практически полностью восстанавливаются без восстановления водорода:
Сu2+ + 2е = Сu0.
Последовательность окисления ионов на аноде зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Различают аноды нерастворимые (инертные) и растворимые (активные). К первым относят электроды из графита, металлов, стоящих в ряду напряжения за водородом, ко вторым – электроды из активных металлов.
На инертных анодах окисляются в первую очередь элементарные ионы в порядке возрастания величины стандартного электродного потенциала, то есть, чем меньше j0, тем легче ионы окисляются (S2–, I–, Br–, Cl–). При наличии кислородсодержащих ионов на аноде окисляются молекулы воды:
2Н2О – 4е = О2 + 4Н+ (рН = 7)
или гидроксильные ионы:
4ОН– – 4е = О2 + 2 Н2О (рН > 7).
Сложные кислородсодержащие ионы из водных растворов практически не окисляются. На активных электродах при электролизе будет окисляться электрод.
Рассмотрим электролиз с нерастворимым анодом водных растворов солей Na2SО4 и СuCl2:
а) в растворе Na2SО4 диссоциирует на ионы:
Na2SО4 ⇄ 2Na+ + SО42– (рН = 7)
К(–) | Na2SО4, Н2О | (+) А.
Na+ SO42–
Н2О Н2О
К(–): 2Н2О + 2 е = Н2 + 2ОН–,
А(+): 2Н2О – 4е = О2 + 4Н+.
Суммарной является реакция разложения воды:
2Н2О = 2Н2 + О2;
б) в растворе СuСl2 диссоциирует: СuСl2 ⇄ Cu2+ + 2Cl–
К (–):Cu2+ + 2e = Cu,
А (+): 2Сl– – 2 е = Сl2.
СuСl2 = Cu + Сl2.
