
51. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений металлов.
Стандартный водородный электрод представляет собой платиновую пластину, покрытую «платиновой чернью» (высокодисперсная платина с огромной удельной поверхностью), частично погруженную в раствор кислоты с активностью ионов гидроксония, равной единице (условие стандартизации). Через раствор, обдувая электрод, пропускают постоянный ток водорода под давлением 1 атм (условие стандартизации). В водородном электроде устанавливаются равновесия:
H2(газ) ↔ 2H(адсорбированный платиной) ↔ 2H3O+ + 2 e-,
или опуская промежуточную стадию адсорбции:
H2(газ) + 2H2O ↔ 2H3O+ + 2 e- ,
т.е. схему данного электрода можно записать как
Pt, H2 (P(H2)=1 атм)| H+ (aH+=1).
Учитывая, что электродный потенциал стандартного водородного электрода равен 0,00 В по определению, теоретически с его помощью можно определить потенциал любого другого электрода, собрав из них электрохимическую ячейку. Например, для электрода, описанного выше:
-Pt, H2 (P(H2)=1 атм)| H+ (aH+=1)||Mn+|M+,
где двойная черта означает солевой мостик или полупроницаемую мембрану между растворами электролитов. Расположение электродов в данной схематической записи электрохимической ячейки отвечает рекомендациям IUPAC, т.е., если электродная реакция, записанная в сторону восстановления, является самопроизвольной, то потенциал электрода будет положительным. Если же с помощью указанной ячейки определить потенциал электрода в стандартных условиях (т.е. поместить электрод в раствор соответствующего электролита с активностью равной единице), то полученный потенциал будет стандартным электродным потенциалом данного вещества при данной температуре, и является термодинамическим параметром данной сопряженной окислительно-восстановительной пары в стандартных условиях:
Mn+ + ne- → M, E°Mn+/M.
Зная значение относительного стандартного потенциала вещества (они приводятся в термодинамических справочниках), с помощью уравнения Нернста можно определить зависимость относительного потенциала электрода первого рода от активности электролита:
EMn+/M = E°Mn+/M + RT/nF·lnaMn+.
Таким образом, собрав выше описанную электрохимическую ячейку, можно использовать данный электрод в качестве индикаторного для определения активности ионов Mn+.
Так как материал данного индикаторного электрода участвует в исследуемом обратимом окислительно-восстановительном процессе, то он относится к активным металлическим электродам. В случае же если электрод непосредственно не участвует в окислительно-восстановительном процессе, а служит только переносчиком электронов от восстановленной формы к окисленной (например, как у описанного выше водородного электрода), он относится к инертным металлическим электродам (редокс-электрод). Потенциалы инертных электродов являются функцией соотношения активностей окисленной и восстановленной форм вещества:
Ox + ne- = Red, EOx/Red = E°Ox/Red + RT/nF·lnaOx/aRed.
Подобного рода электроды изготавливают из благородных металлов (Au, Pt) и применяют в потенциометрическом окислительно-восстановительном титровании.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом[1]. Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон, устанавливающий зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.
{\displaystyle E=E^{0}+{\frac {RT}{nF}}\ln {\frac {a_{\rm {Ox}}}{a_{\rm {Red}}}}}

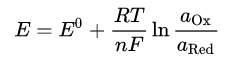
, где:
{\displaystyle \ E}E — электродный потенциал, {\displaystyle E^{0}}E0 — стандартный электродный потенциал, измеряется в вольтах;
{\displaystyle \ R}R — универсальная газовая постоянная, равная 8,314 Дж/(моль·K);
{\displaystyle \ T}T — абсолютная температура;
{\displaystyle \ F}F — постоянная Фарадея, равная 96485,55 Кл·моль−1;
{\displaystyle \ n}n — число электронов, участвующих в процессе;
{\displaystyle \ {a_{\rm {Ox}}}}aOx и {\displaystyle \ {a_{\rm {Red}}}}aRed — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант {\displaystyle R}R и {\displaystyle F}F и перейти от натуральных логарифмов к десятичным, то при {\displaystyle T=298{\rm {K}}}T = 298K получим
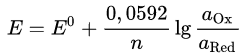
Стандартный потенциал
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0,036 В
Fe2+ + 2e− → Fe(тв) −0,44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0,77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД
НАПРЯЖЕНИЙ,
последовательность расположения электродов в
порядке возрастания их стандартных электродных
потенциалов (см. Стандартный
потенциал).
Металлические электроды в
водном растворе электролита образуют
следующий электрохимический ряд
напряжений:
Li, К, Rb, Ba, Sr, Ca, Na, Се, Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga,
Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2,
Bi, Cu, Hg, Ag, Pt, O2,
Au. Для сравнения включены водородный
электрод (Pt,
H2[l
атм] | Н+ ),
потенциал которого при давлении водорода
1,01 * 105 Па
и термодинамические активности а ионов Н+ в
водном растворе, равной 1, при всех
температурах принимается равным нулю
(потенциалопределяющая реакция Н+ +
е![]() 1/2Н2,
где е - электрон)
и кислородный электрод (потенциалопределяющая
реакция О2 +
2Н2О
+ 4е
1/2Н2,
где е - электрон)
и кислородный электрод (потенциалопределяющая
реакция О2 +
2Н2О
+ 4е![]() 4ОН-).
Электрохимический ряд
напряжений позволяет
судить о термодинамической возможности
протекания тех или иных электродных
процессов. Металл с
более отрицательным потенциалом может
вытеснять металл с
менее отрицательным потенциалом из
растворов его солей,
растворяясь при этом. Металлы,
имеющие отрицательный стандартный
потенциал по
сравнению с водородным
электродом (так
называемые электроотрицательные металлы),
в растворах с не слишком большой
термодинамической активностью ионов металла имеют
более отрицательный потенциал,
чем водородный
электрод в
сильно кислых растворах. Поэтому при
замыкании такого электрода с
водородным между ними протекает
ток, металл
растворяется, а на водородном
электроде выделяется водород (см. Анодное
растворение).
Электроотрицательные металлы
термодинамически неустойчивы в водных
растворах (их называют неблагородными металлами)
и осаждаются на катоде при
более отрицательном потенциале, чем
потенциал выделения
Н2 (см. Электроосаждение).
Металлы,
потенциал которых менее положительный,
чем у кислородного электрода,
термодинамически неустойчивы в контакте
с О2 (или воздухом)
и водой.
Поэтому электрохимический ряд
напряжений служит
для ориентировочных оценок скорости
электрохимической коррозии в водных
растворах при обычных температурах, а
также для выбора безопасных
контактных пар (гальванических пар)
разнородных металлов.
Если металл электроотрицательнее,
чем Н2,
то может идти активный коррозионный
процесс (см. Коррозия
металлов, Коррозионностойкие
материалы, Электрохимическая
защита).
Практическая реализация электродных
процессов определяется
наряду с термодинамическими также и
кинетическими факторами (см. Электрохимическая
кинетика).
Положение
в электрохимическом ряду
напряжений металлов,
образующих ионы разного
заряда, зависит от природы
соответствующих ионов.
Аналогичные ряды
напряжений можно
построить для неметаллических и
редокс-электродов (окислительно-восстановительных).
4ОН-).
Электрохимический ряд
напряжений позволяет
судить о термодинамической возможности
протекания тех или иных электродных
процессов. Металл с
более отрицательным потенциалом может
вытеснять металл с
менее отрицательным потенциалом из
растворов его солей,
растворяясь при этом. Металлы,
имеющие отрицательный стандартный
потенциал по
сравнению с водородным
электродом (так
называемые электроотрицательные металлы),
в растворах с не слишком большой
термодинамической активностью ионов металла имеют
более отрицательный потенциал,
чем водородный
электрод в
сильно кислых растворах. Поэтому при
замыкании такого электрода с
водородным между ними протекает
ток, металл
растворяется, а на водородном
электроде выделяется водород (см. Анодное
растворение).
Электроотрицательные металлы
термодинамически неустойчивы в водных
растворах (их называют неблагородными металлами)
и осаждаются на катоде при
более отрицательном потенциале, чем
потенциал выделения
Н2 (см. Электроосаждение).
Металлы,
потенциал которых менее положительный,
чем у кислородного электрода,
термодинамически неустойчивы в контакте
с О2 (или воздухом)
и водой.
Поэтому электрохимический ряд
напряжений служит
для ориентировочных оценок скорости
электрохимической коррозии в водных
растворах при обычных температурах, а
также для выбора безопасных
контактных пар (гальванических пар)
разнородных металлов.
Если металл электроотрицательнее,
чем Н2,
то может идти активный коррозионный
процесс (см. Коррозия
металлов, Коррозионностойкие
материалы, Электрохимическая
защита).
Практическая реализация электродных
процессов определяется
наряду с термодинамическими также и
кинетическими факторами (см. Электрохимическая
кинетика).
Положение
в электрохимическом ряду
напряжений металлов,
образующих ионы разного
заряда, зависит от природы
соответствующих ионов.
Аналогичные ряды
напряжений можно
построить для неметаллических и
редокс-электродов (окислительно-восстановительных).
