
- •46. Окислительно‐восстановительные реакции. Ионно‐электронный
- •47. Возникновение скачка потенциала на границе раздела «металл‐
- •48.Равновесный электродный потенциал.
- •50. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс
- •Гальванический элемент
50. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс
Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.
Влияние природы реагирующих веществ.
Пусть протекает реакция: M + Nn+ → Mn+ + N
Максимальная
полезная работа:



Реакция 2: L + Dm+ → Lm+ + D

Вывод: В зависимости от природы веществ, ЭДС будет меняться.
Влияние температуры.
Согласно уравнению Гиббса-Гельмгольца, работа реакции. При наличии исходных термохимических данных можно рассчитать ЭДС. 2)Зависимость от температуры:
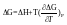
Сделаем подстановки:
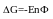
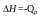
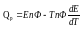

Qp – теплота реакции, которая выделяется или поглощается при ее необратимом проведении. Если реакция протекает обратимо, то часть энергии реакции превращается в работу А, а часть q остается в виде теплоты в элементе, q характеризует связанную энергию.
Определив градиент ЭДС, можно вычислить изменение энтропии для реакции.
Если
q<0,
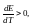 т.е. ЭДС уменьшается с ростом температуры.
т.е. ЭДС уменьшается с ростом температуры.
Если
q>0,
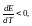 т.е. ЭДС растет с ростом температуры.
т.е. ЭДС растет с ростом температуры.
Для
гальванических элементов q
подбирают малым, чтобы

Влияние концентрации.
Пусть
реакция
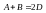
Изотерма
реакции:

С - концентрация
Преобразуем
левую
и правую части делим на ![]() и получим:
и получим:

Обозначим
первое слагаемое за
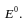
Это
стандартная ЭДС, она отвечает случаю
равенства единице концентраций всех
участвующих веществ, т.е. стандартному
изменению свободной энергии реакции
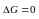
Если
температура постоянная, то ![]()
![]() -
стандартная Э.Д.С., соответствующая тому
простому случаю, когда
-
стандартная Э.Д.С., соответствующая тому
простому случаю, когда ![]()
Для стандартных условий: Т=298 К, р=1атм
![]() -
уравнение
Нернста
для гальванического элемента.
-
уравнение
Нернста
для гальванического элемента.
Ф
= 96500 ![]()
Гальванический элемент
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле Нернста:
![]() ,
,
где aOx и aRed - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo - стандартный потенциал электрода (при aOx = aRed =1); n - число электронов, участвующих в полуреакции; R - газовая постоянная; T - абсолютная температура; F - постоянная Фарадея. При 25o C
![]()
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
E = EП - EЛ.
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
![]() .
.
Для элемента Даниэля стандартная ЭДС равна
Eo = Eo (Cu2+/Cu) - Eo (Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.
ЭДС
элемента связана с ![]() G протекающей
в элементе реакции:
G протекающей
в элементе реакции:
G = - nFE.
Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
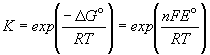 .
.
Константа равновесия реакции, протекающей в элементе Даниэля, равна
 =
1.54. 1037.
=
1.54. 1037.
Зная температурный
коэффициент ЭДС ![]() ,
можно найти другие термодинамические
функции:
,
можно найти другие термодинамические
функции:
S =
H = G + T S = - nFE + .
