
- •46. Окислительно‐восстановительные реакции. Ионно‐электронный
- •47. Возникновение скачка потенциала на границе раздела «металл‐
- •48.Равновесный электродный потенциал.
- •50. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс
- •Гальванический элемент
46. Окислительно‐восстановительные реакции. Ионно‐электронный
метод подбора коэффициентов в окислительно‐восстановительных
реакциях.
Окислительно-восстановительные процессы связаны с перераспре-
делением электронов между атомами или ионами веществ, участвующих в
реакции.
Принято считать процесс отдачи веществом электронов окислением, а
процесс присоединения электронов – восстановлением.
Ионно‐электронный метод подбора коэффициентов в окислительно‐восстановительных реакциях:
Вначале составляют частные схемы процесса окисления и процесса
восстановления, записывая вещества в той форме, в какой они существуют в
растворе: сильные электролиты - в ионной форме, слабые электролиты, ма-
лорастворимые вещества и газы – в молекулярной.
С участием ионов среды (
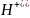 в кислой,
в кислой,
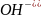 в щелочной) или молекул
в щелочной) или молекул
 О
осуществляют материальный баланс, а
затем электронный баланс.
О
осуществляют материальный баланс, а
затем электронный баланс.
В
кислой среде
добавляется
и
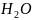
В
щелочной
среде

В
нейтральной
среде

Составленные уравнения полуреакций суммируют, умножая на соответствующие коэффициенты, подобранные таким образом, чтобы число электронов, теряемых восстановителем, было равно числу электронов, при- обретаемых окислителем. В результате получают ионно-молекулярное уравнение окислительно-восстановительной реакции.
Переносят соответствующие коэффициенты из ионно-молекулярного уравнения в схему реакции, написанной в молекулярной форме, и уравнивают количество ионов, не принимавших участия в процессах окисления и восстановления.
47. Возникновение скачка потенциала на границе раздела «металл‐
раствор».
Если пластину любого металла погрузить в воду или раствор электролита, содержащий ионы этого металла, то небольшая часть металла перейдет в раствор, в форме положительно заряженных ионов, а сама пластина, концентрируя на себе избыток свободных электронов, приобретает отрицательный заряд. Такому переходу содействует связывание ионов металла с молекулами воды (растворителя). В итоге устанавливается равновесие
Me ↔ Me2+ + 2e
Me2+ + m H2O ↔ Me2+ · m H2O
Me + m H2O ↔ Me2+ · m H2O +2e
Положительно заряженные ионы Me+2, перешедшие в раствор, концентрируются у поверхности пластины, приобретающей отрицательный заряд, в результате возникает двойной электрический слой (ДЭС) , обусловливающий резкий скачок электрического потенциала на границе металл - раствор электролита.
Эту разность электрических потенциалов или скачок потенциала на границе металл-раствор электролита называют электродным потенциалом.
Величина электродного потенциала зависит от природы металла, концентрации, точнее активности ионов металла в растворе и температуры.
Математически эта зависимость выражается уравнением В.Г.Нернста (1888).


Уравнение Нернста
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
ΔGoяч = –nFEoяч
где n – количество моль электронов на моль продуктов,
F – постоянная Фарадея 96485 Кл/моль (заряд, переносимый 1 моль ē).
Таким образом применимы следующие правила:
если Eoяч > 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч < 0, тогда процесс не самопроизвольный (электролитическая ячейка)
Стандартные электродные потенциалы даны при стандартных условиях.
Однако реальные ячейки могут действовать и при нестандартных условиях.
При данном стандартном потенциале потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
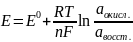
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для газовой фазы величины потенциалов также зависят от давления.
Указанные процессы приводят к возникновению двойного электрического слоя и скачка потенциала между отрицательно заряженной пластинкой и слоем положительно заряженных ионов в растворе.
Двойной электрический слой – слой ионов, образующийся на поверхности раздела фаз в результате либо адсорбции ионов из раствора, либо процессов диссоциации в поверхностном слое, либо ориентирования полярных молекул на границе раздела фаз.
Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этой части двойного электрического слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Некоторые металлы (например, золото, платина) обладают столь прочной кристаллической решеткой, что катионы не могут освободиться. Если такой металл погрузить в электролит, содержащий ионы, в состав которых входят элементы в различных степенях окисления (такие системы называют окислительно-восстановительными или редокс-электродами), то будет происходить обмен электронами между инертным электродом и ионами, что также приведет к образованию двойного электрического слоя и возникновению равновесного скачка потенциала.
Двойной электрический слой и соответствующая разность потенциалов возникают также при ионообменных процессах на границах: стекло/раствор, ионообменная смола/раствор и др.
При погружении металла в раствор его соли наблюдается аналогичная картина, но равновесие наступает при другом скачке потенциала, зависящем не только от свойств металла, но и от концентрации (точнее активности) ионов в растворе.
Возникновение скачка потенциала на границе раздела фаз вызывается различными причинами, зависящими от природы граничащих фаз. Металлы, имеющие отрицательные значения электродных потенциалов, стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот. Чем меньше электродный потенциал металла Е0 ,тем легче он окисляется и труднее восстанавливается из своих ионов. Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
