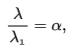- •41. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •42. Константа диссоциации. Закон разведения Оствальда.
- •43. Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •44. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Определение водородного показателя
- •45. Гидролиз солей. Константа и степень гидролиза.
- •Соли сильного основания и слабой кислоты
- •Соли слабого основания и сильной кислоты
- •Соли, образованные слабым основанием и слабой кислотой.
41. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
Электролитическая диссоциация — это самопроизвольный частичный или полный распад растворённых электролитов на ионы.
Электролиты при растворении в воде диссоциируют на ионы — положительно и отрицательно заряженные.
Под действием электрического тока ионы приобретают направленное движение. Положительно заряженные движутся к катоду, а отрицательно заряженные движутся к аноду. Из чего первые называются катионами, а вторые — анионами.
Диссоциация — это обратимый процесс. Это означает, что в какой-то момент наступает такое состояние равновесия, при котором сколько молекул электролита распадаются на ионы, столько их и образуется вновь. По этому в уравнениях диссоциации вместо знака равенства ставят знак обратимости.
Пример:
КА = К++А-
Степенью диссоциации «а» называется отношение числа молекул, распавшихся на ионы, к общему числу молекул электролита в растворе.
Степень диссоциации зависит от:
природы электролита;
его концентрации;
температуры.
По природе электролиты делятся на два типа:
Сильные электролиты — это вещества, которые при растворении в воде практически полностью распадаются на ионы.
Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HСlO4 H2SO4, HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2). В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. Степень диссоциации сильных электролитов α > 30%.
Слабые электролиты — это вещества, частично диссоциирующие на ионы.
Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Степень диссоциации α < 3%. К слабым электролитам относятся почти все органические кислоты (CH3COOH, C2H5COOH и др.); некоторые неорганические кислоты (H2CO3, H2S и др.); почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH3H); вода. Они плохо (или почти не проводят) электрический ток.
42. Константа диссоциации. Закон разведения Оствальда.


Формулировка закона разведения Оствальда: Степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
С увеличением разведения (уменьшением концентрации) степень диссоциации электролита возрастает. По мере разбавления раствора вероятность столкновения ионов падает и степень электролитической диссоциации a растет. Если в растворе бинарного электролита КА – степень диссоциации a, то концентрация ионов К+ и А- одинаковы и равны. Для сильных электролитов нельзя применять закон Оствальда, хотя деление на сильные и слабые электролиты условно. У сильных говорят о кажущейся степени диссоциации.

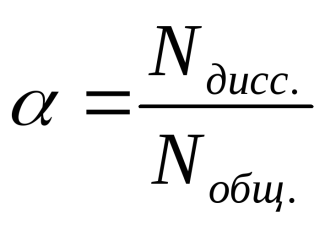
Константой диссоциации называется константа равновесия, соответствующая процессу диссоциации слабого электролита.
Величина константы диссоциации зависит от природы электролита и растворителя, температуры, но не зависит от концентрации электролита в растворе. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем легче электролит диссоциирует на ионы, тем больше константа диссоциации.
Числовой показатель константы диссоциации является табличным значением.
Закон разведения Освальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора.
К — константа диссоциации электролита,
с — концентрация, λ и λ1 — значения
эквивалентной электропроводности при
концентрации с и при бесконечном
разбавлении соответственно. Соотношение
является следствием закона действующих
масс и равенства