
- •31. Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константы скорости с константой равновесия.
- •32. Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции.
- •33. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •34. Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •35. Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
33. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
С повышением температуры скорость реакции резко увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа:
при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза.
Величина, которая показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции γ .
 .
.
Поскольку при концентрациях реагирующих веществ I моль/л скорость химической реакции численно равна константе скорости k, то
 .
.
Определив γ, можно приближенно рассчитать скорость (константу скорости) реакции при любой температуре:
 или
или 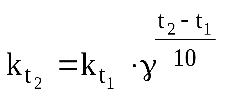
Правило Вант-Гоффа применяется для ориентировочных расчётов. Более точно зависимость скорости (константы скорости) реакции от температуры описывается уравнением Аррениуса:
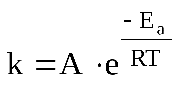 ,
,
где Еа – энергия активации реакции; R – универсальная газовая постоянная, R=8,314 Дж/моль∙К; Т – температура, К; A –предэкспоненциальный множитель (коэффициент Аррениуса).
34. Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.

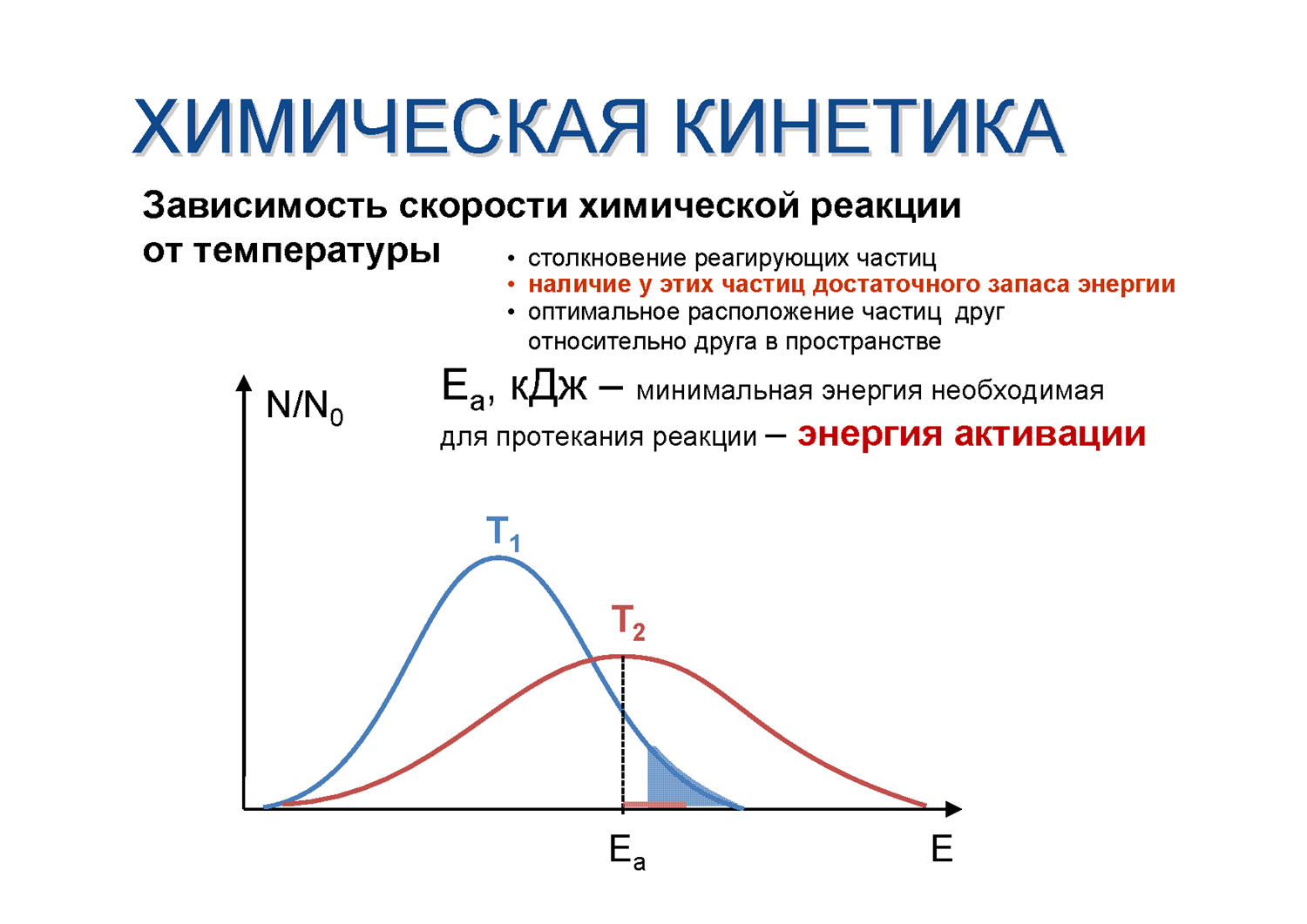



Энергия активации – избыточная энергия, которой должны обладать частицы для вступления в химическую реакцию. Энергия активации является постоянной величиной для данной химической реакции и практически не зависит от температуры.
Чем больше активных молекул принимают участие в химической реакции, тем больше скорость реакции. Увеличение скорости реакции при повышении температуры обусловлено ростом доли активных молекул и числа столкновений между ними. Для определения величины энергии активации используют уравнение Аррениуса в интегральной и дифференциальной формах. Расчет энергии активации можно вести графическим и аналитическим способом.
![]()
Графический способ: Энергию активации графическим способом можно найти, если прологарифмировать уравнение Аррениуса:

Аналитический способ: Энергию активации химической реакции можно вычислить по значениям констант скоростей при двух различных температурах по уравнению:

Отсюда, уравнение для расчета энергии активации имеет вид:

35. Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
Гетерогенной реакцией называется реакция, в которой реагирующие вещества находятся в разных фазах. К гетерогенным относятся реакции между веществами, находящимися в разных агрегатных состояниях.
Скорость гетерогенной химической реакции равна изменению количества любого исходного вещества в единицу времени на единицу площади поверхности раздела фаз:
![]() .
.
Особенностью кинетики гетерогенных реакций является влияние на скорость реакции площади реакционной поверхности и ее состояния.
С увеличением площади поверхности скорость гетерогенной реакции возрастает.
Однако следует помнить важное правило:
если в гетерогенной реакции непосредственно принимает участие твердое вещество, то в кинетическое уравнение не входит его концентрация, которая считается постоянной.
Например, для гетерогенной реакции Са(к) + СО2(г)=CaCO3(к) кинетическое уравнение имеет вид:
= k·C(CO2) = k·[CO2].
Большинство гетерогенных реакций включает три основные стадии (рис. 7.7):
1) подвод одного реагирующего вещества к поверхности другого;
2) химическое взаимодействие на по-верхности;
3) отвод образовавшегося продукта от поверхности.

Рисунок 7.7 – Стадии гетерогенных реакций:
а) подвод одного реагирующего вещества к поверхности другого;
б) химическое взаимодействие на поверхности;
в) отвод образовавшегося продукта от поверхности твердого реагента
Самая медленная стадия, которая определяет скорость реакции в целом, называется лимитирующей.



Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа.
В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:
5. Десорбция продуктов реакции с поверхности катализатора.
6. Диффузия продуктов реакции от поверхности катализатора.
