
- •26. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •27. Третий закон термодинамики. Постулат Планка.
- •28. Условия самопроизвольного протекания химических реакций.
- •29. Константа химического равновесия. Расчёт Кр и Кс.
- •30. Химическое равновесие. Принцип Ле-Шателье.
29. Константа химического равновесия. Расчёт Кр и Кс.
Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
аA + вB D сC + dD,
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
uпр = k1CАаCВв (6.1)
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
uобр = k2CCсCDd (6.2)
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
k1CАаCВв = k2CCсCDd (6.3)
Перенесем константы скорости в одну сторону, а концентрации в другую:
![]() (6.4)
(6.4)
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
![]() (6.5)
(6.5)
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Способы выражения константы равновесия
Если
концентрации веществ, участвующих в
реакции, выражены в молярных единицах
молярности , т.е. в моль/л, то она обычно
обозначается Кс
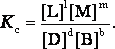
Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:
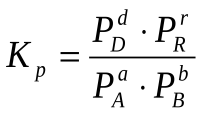
Иногда
константу равновесия удобно выразить
не через парциальные давления и
концентрации, а через количества веществ:
![]() или
через соответствующие мольные доли:
или
через соответствующие мольные доли:
В общем случае константы равновесия Кс, Кр, Кn и КN различны.
Константа равновесия и энергия изменения Гиббса.
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:
![]()
где ![]() —
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная газовая постоянная.
—
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ![]()
![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]()
![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]()
![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
![]()
Связь между Кс и Кр можно выразить соотношением:
Кр = Кс·(RT)n ,
где n –изменение числа молей газов в результате реакции.
Например, при протекании реакции:
2СО + О2 = 2СО2
n = 1, следовательно, Кр = Кс·RT
Для получения зависимости константы равновесия Кр от температуры используем уравнение Гиббса — Гельмгольца:
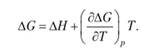 (6.5)
(6.5)
Это уравнение отличается от известного уравнения для ΔG = ΔH - TΔS тем, что изменение энтропии ΔS в нем задано в неявном виде.
Учитывая то, что К'р в уравнении изотермы Ванг-Гоффа (6.4) не зависит от температуры (так как парциальные неравновесные давления участников реакции имеют определенные фиксированные значения), получим в результате дифференцирования этого уравнения
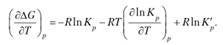
Подставим в уравнение (6.5) это выражение, а также уравнение изотермы Вант-Гоффа (6.4). После сокращения получим
 (6.6)
(6.6)
Это уравнение называется изобарой химической реакции.
Аналогично получаем уравнение изохоры химической реакции:
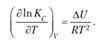 (6.7)
(6.7)
Из этих уравнений очевидно, что, если тепловой эффект реакции имеет отрицательное значение (ΔН < 0 или ΔU < < 0), то величина константы равновесия с ростом температуры уменьшается, и равновесие смещается в сторону исходных веществ. Если ΔН > 0 (или ΔU > 0), то константа равновесия растет с увеличением температуры и равновесие смещается в сторону продуктов реакции. При ΔII = 0 (или ΔU = 0) величина константы равновесия не зависит от температуры. Эти же закономерности следуют из эмпирического принципа Ле Шателье.
Разделяя переменные в уравнениях (6.6) и (6.7) и интегрируя при ΔН = = const (или ΔU - const), получаем
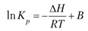
и
![]()
где В и В' — некие константы.
Из этих уравнений очевидно, что если тепловой эффект не зависит от температуры, то график зависимости, например, InКр от 1 /Т представляет собой прямую линию. Если известны константы равновесия для нескольких температур, то, построив график в координатах пКр - f(/T), можно определить константу интегрирования и тепловой эффект реакции. Для более точных расчетов нужно учитывать, что тепловой эффект химической реакции тоже зависит от Г.
Если проинтегрировать уравнения (6.6) и (6.7) с учетом граничных температур Т{ и Т2 при постоянных величинах тепловых эффектов, получим выражения, которые можно использовать для оценки Кр (или Кс ) при любых температурах:
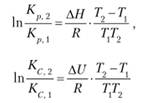
В таких расчетах надо знать ΔН (или ΔU) и значение Кр (или Кс) при одной температуре.
