
- •26. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •27. Третий закон термодинамики. Постулат Планка.
- •28. Условия самопроизвольного протекания химических реакций.
- •29. Константа химического равновесия. Расчёт Кр и Кс.
- •30. Химическое равновесие. Принцип Ле-Шателье.
26. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
G H – TS |
Новая функция, связывающая энтальпию и энтропию – энергия Гиббса
|
ΔG = (ΔH – TΔS) < 0 |
Изменение энергии Гиббса при P = const и T = const определяет самопроизвольность процесса
|
ΔU = Q – Aрасш + E |
Если процесс обратимый, то согласно II закону термодинамики: ΔU = TΔS – Aрасш + E
|
При P = const
E = ΔU +PΔV – TΔS = ΔG
|
(Объединенная формула первого и второго начала термодинамики) |
Величина ΔG характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу.
При V=const
F U – TS – энергия Гельмгольца.
В изохорном процессе полезная работа определяется изменением энергии Гельмгольца, а условием самопроизвольности процесса является ее уменьшение ΔF < 0
|
В неизолированных системах процесс протекает самопроизвольно если ему соответствует уменьшение энергии Гиббса. Состояние системы, которому соответствует ΔG = 0 называют состоянием равновесия
|
Уравнения Гиббса – Гельмгольца
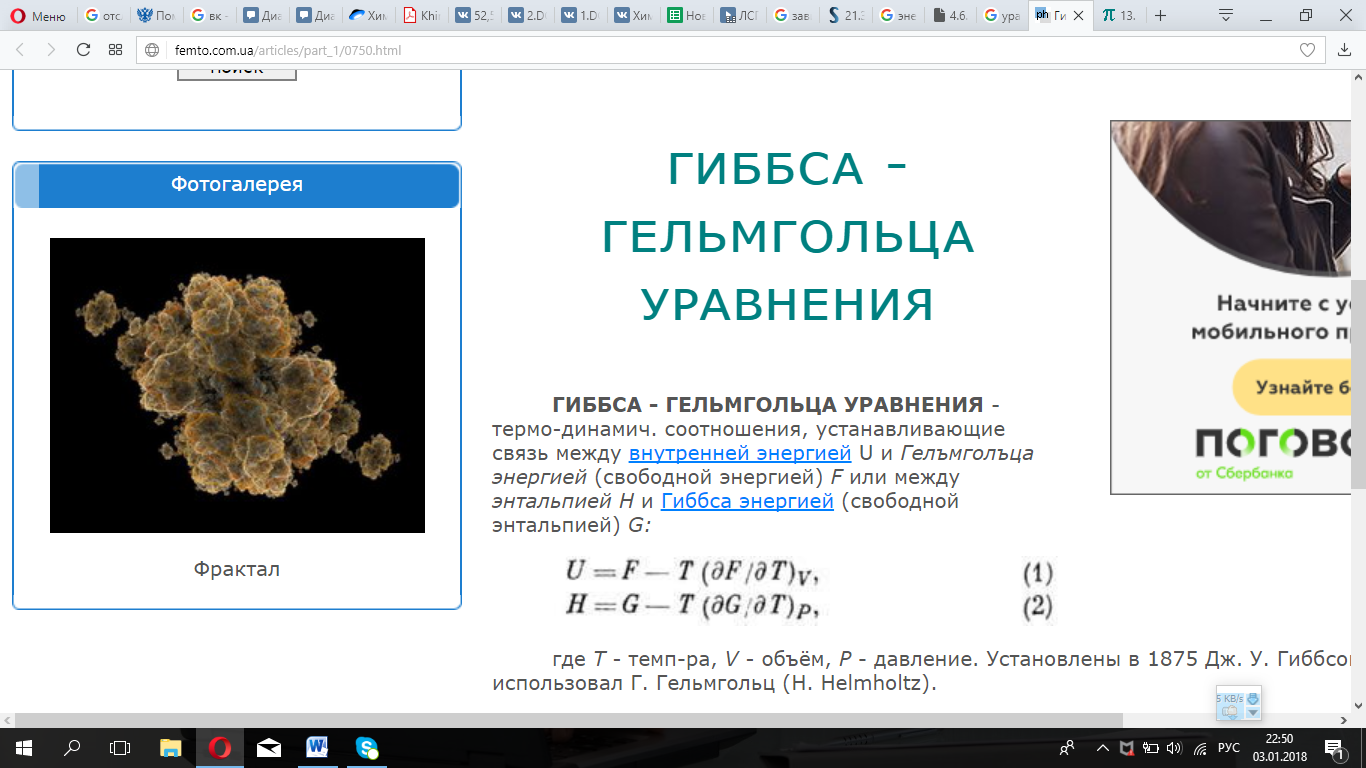
Уравнения Гиббса – Гельмгольца - термодинамические соотношения, устанавливающие связь между внутренней энергией U и Гельмгольца энергией (свободной энергией) F или между энтальпией H и Гиббса энергией (свободной энтальпией) G.
Уравнение
(1) следует из определения энергии
Гельмгольца F=U-TS и выражения для энтропии![]() .
.
Уравнение (1) позволяет по энергии Гельмгольца F(T, V) найти внутреннюю энергию U(T, V)и ,следовательно, теплоёмкость при постоянном объёме.
Уравнение
(2)-из определения энергии Гиббса G=H-TS и
выражения для энтропии![]() .
.
Уравнениение (2) позволяет по энергии Гиббса G(T, P)найти энтальпию H(T, P)и, следовательно, теплоёмкость при постоянном давлении.
Энергия Гиббса G
 ,
где ΔН — изменение энтальпии H; ΔS —
изменение энтропии S.
,
где ΔН — изменение энтальпии H; ΔS —
изменение энтропии S.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
Если ΔG отрицательно (ΔG<0), то реакция протекает самопроизвольно в прямом направлении.
Если ΔG равно нулю (ΔG=0), то реакция находится в равновесном состоянии.
Если ΔG положительно (ΔG>0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Энергия Гельмгольца F
Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением:
F = U – TS
Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением:
ΔF= ΔU – TΔS
Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых F уменьшается.
Таким образом, при ΔF<0 процесс идет самопроизвольно в прямом направлении,
при ΔF>0 – в обратном направлении,
а при ΔF=0 система находится в состоянии равновесия.
Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия:
ΔG0Т = ΔH0Т – TΔS0Т = —RTlnK,
Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура.
Если K>>1, т.е. реакция идет в прямом направлении, то ΔG0˂˂0.
Если K<<1, т.е. реакция идет в обратном направлении, то ΔG0>>0
Если K=1, то ΔG0=0
В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG0 можно связать с ЭДС гальванического элемента следующим соотношением:
ΔG0=-nFE0, где
nF – количество прошедшего электричества
E0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии.


