
- •16. Направленность ковалентной связи. Σ‐ и π‐связи. Гибридизация
- •17. Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •18. Донорно-акцепторный механизм ковалентной связи Комплексные соединения.
- •19. Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Метод молекулярных орбиталей
- •20. Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
19. Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
Основная идея ММО, заключается в том, что все электроны находятся на молекулярных орбиталях, единых для всей системы ядер и электронов данной молекулы.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
1. При образовании молекулы по ММО изменяют своё состояние не только валентные электроны, а все электроны соединяемых атомов. Они переходят с АО (атомных орбиталей) (одно ядро, одноцентровые) на более сложные многоцентровые – МО (молекулярные орбитали)
2. МО – это объём пространства в поле нескольких ядер, где вероятность нахождения электронов составляет 90-95%
3. Для получения МО используют метод линейной комбинации атомных орбиталей МО ЛКАО. Из двух АО разных атомов образуется две МО:
а) связывающая, которая характеризуется меньшим запасом энергии по сравнению с запасом энергии АО;
б) разрыхляющая – с большим запасом энергии.
4.
Число МО равно сумме АО соединяемых
атомов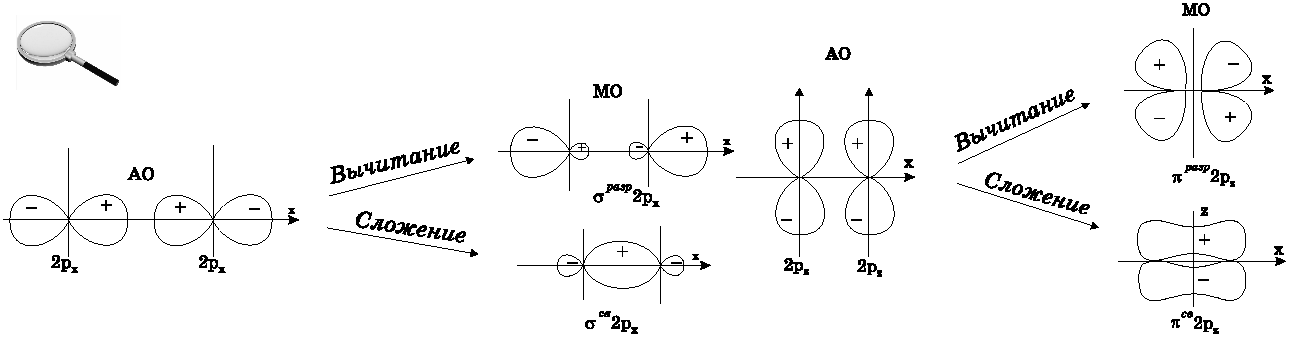
5. Распределение электронов на МО молекулы подчиняется тем же правилам, что и по АО в атоме (принцип минимума полной энергии молекулы, запрет Паули, правило Гунда)
6. Химическая связь в ММО характеризуется энергией связи и кратностью связи (р). Если р> 0, то химическая связь реализуется. Чем больше p, тем больше энергия и прочность связи
СВЯЗЫВАЮЩИЕ И РАЗРЫХЛЯЮЩИЕ ОРБИТАЛИ
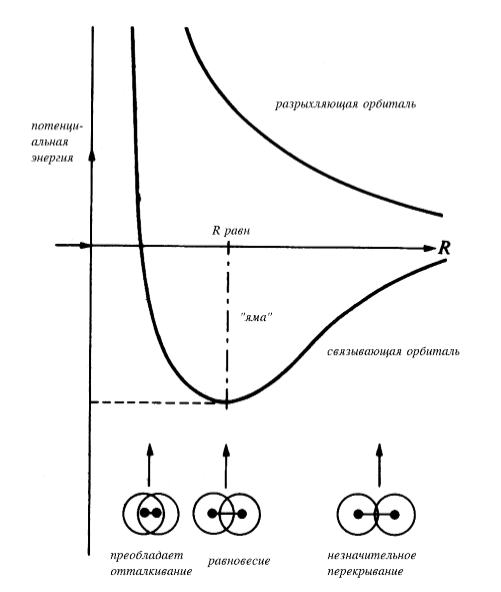
Исходное энергетическое состояние в атомах вырождено, но при соединении атомов в молекулу оно расщепляется на два новых энергетических состояния: одно с более низкой, а другое с более высокой энергией, чем исходное атомное состояние.
По терминологии теории молекулярных орбиталей, орбиталь, которой соответствует меньшая энергия, называется связывающей, орбиталь с большей энергией называется разрыхляющей. Для любого расстояния между ядрами можно вычислить общую энергию молекулы; полученная зависимость носит название кривой потенциальной энергии молекулы (рис. 2). На кривой имеется минимум («яма»), соответствующий стабильному состоянию молекулы с межъядерным расстоянием Rравн, которое носит название равновесной длины связи (или просто длины связи)
Метод молекулярных орбиталей
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее)средней энергии взятых АО.
МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.
Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
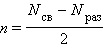
Теперь на примере рассмотрим как можно применить эти правила.
Молекулярно-орбитальные диаграммы элементов первого периода
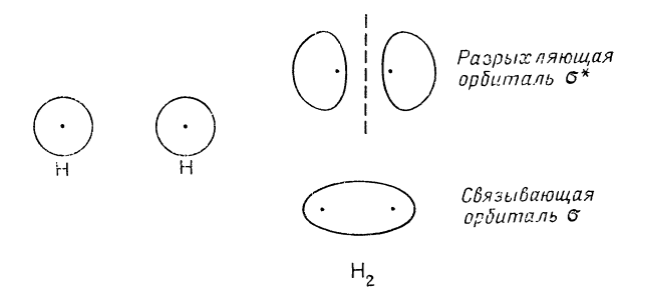
Начнем с образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали. При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется в за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
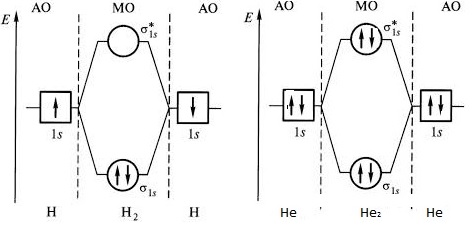
диаграммы МО молекул водорода и гелия
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией σ-орбиталь.
Теперь рассмотрим образования молекулы He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую. Σ*-орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*-орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Далее рассмотрим образования молекулы Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия. Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны. Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
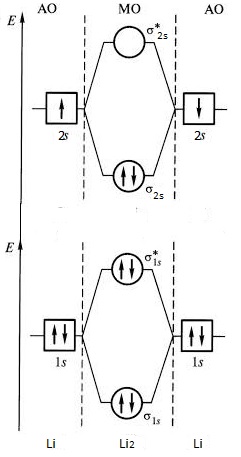
диаграмма МО молекулы лития
Порядок связи n в молекуле Li2 равен 1
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями. Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.
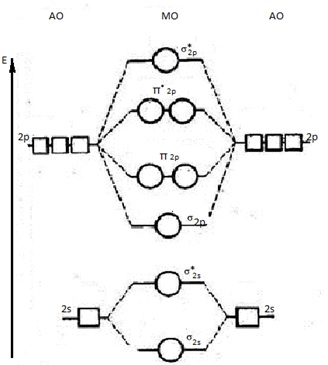
обобщенная диаграмма МО элементов второго периода
Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
2F [1s22s22p5] =F2[(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2(π*2pz)2].
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
F2[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)2(π*z)2],
где К — электронная конфигурация К-слоя.
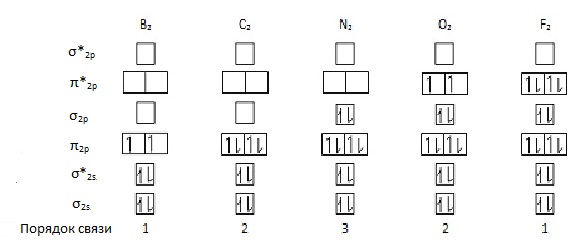 диаграммы
МО двухатомных молекул элементов 2
периода
диаграммы
МО двухатомных молекул элементов 2
периода
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется. Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p- орбитали. Взаимодействие 1s-орбитали атома водорода и 2p- орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p- орбиталь атома фтора играет более важную роль, чем 1s-орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s-орбиталь атома водорода играет более важную роль, чем 2p- орбиталь атома фтора
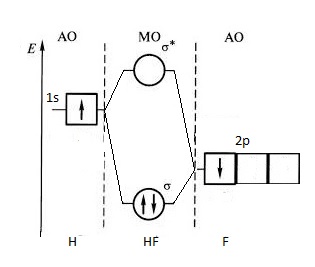
Диаграмма МО молекулы HF
