
- •16. Направленность ковалентной связи. Σ‐ и π‐связи. Гибридизация
- •17. Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •18. Донорно-акцепторный механизм ковалентной связи Комплексные соединения.
- •19. Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Метод молекулярных орбиталей
- •20. Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
16. Направленность ковалентной связи. Σ‐ и π‐связи. Гибридизация
атомных орбиталей.
Ковалентная связь характеризуется направленностью, что обусловлено определенными ориентациями АО в пространстве.
Сигма связь - это связь образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов. Она обычно охватывает 2 атома и не простирается за их пределы
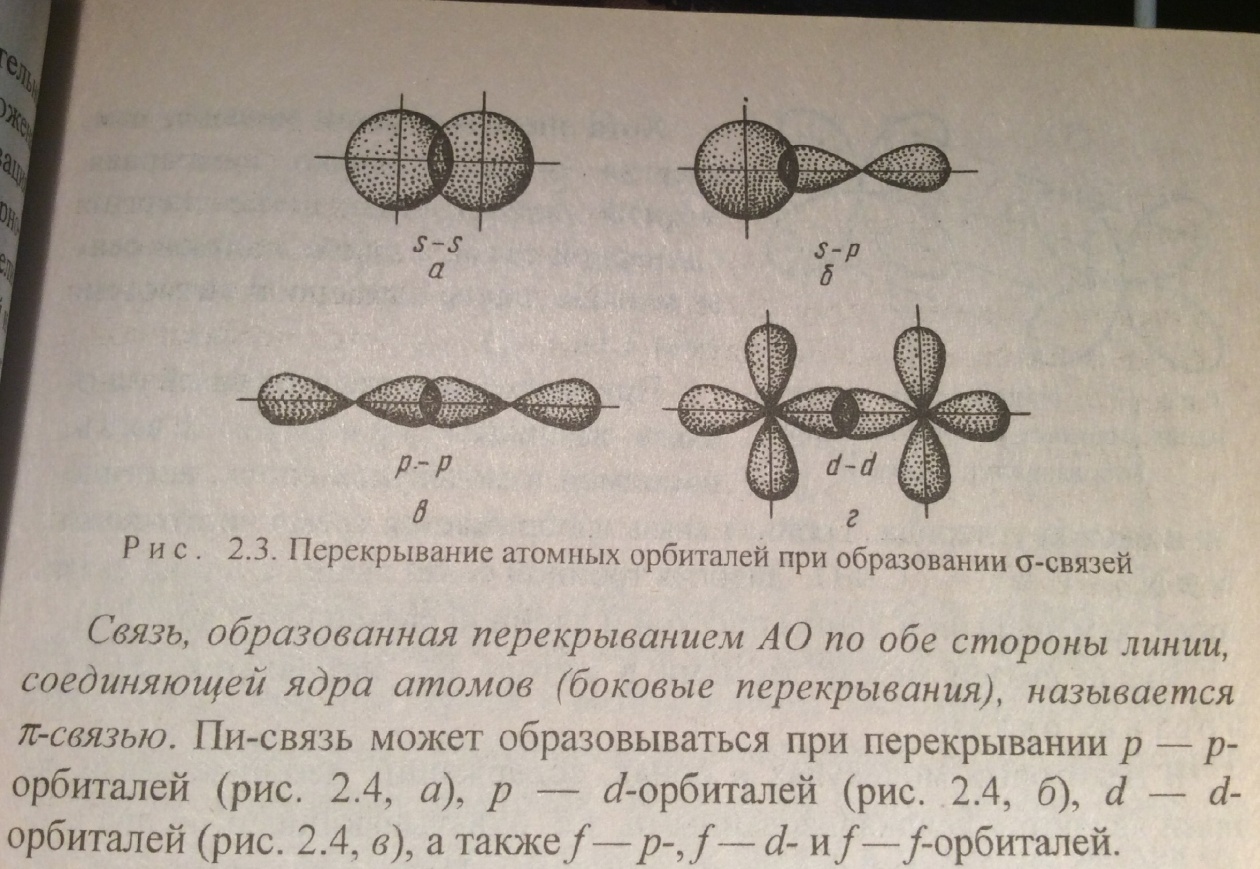 .
.
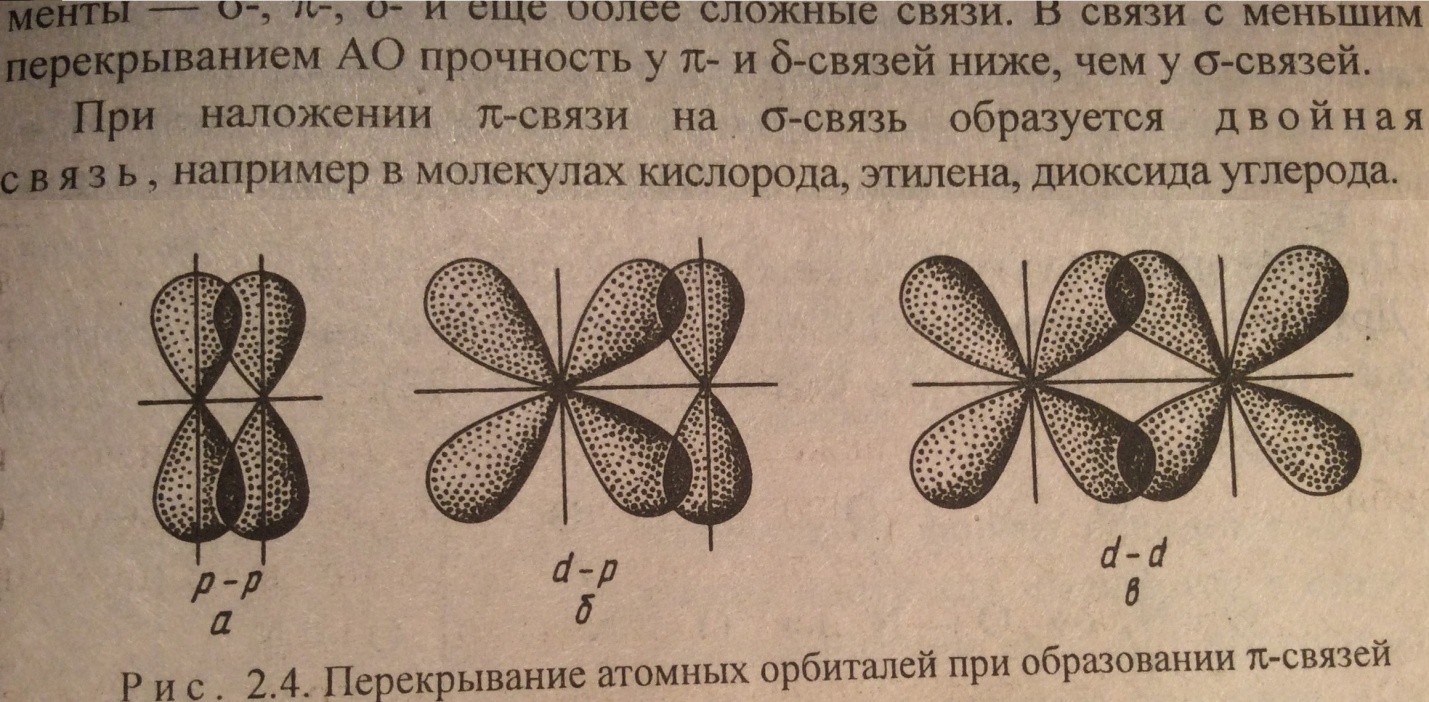
Энергия Пи связи меньше, чем сигма, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной. При наложении двух Пи на Сигму образуется ТРОЙНАЯ связь. Тройная связь обозначается тремя черточками. N≡N, —C≡C—, C≡O. Энергия тройной выше, чем двойной, а длина связи ниже двойной и одинарной.
--------
Гибридизация
атомных орбиталей.

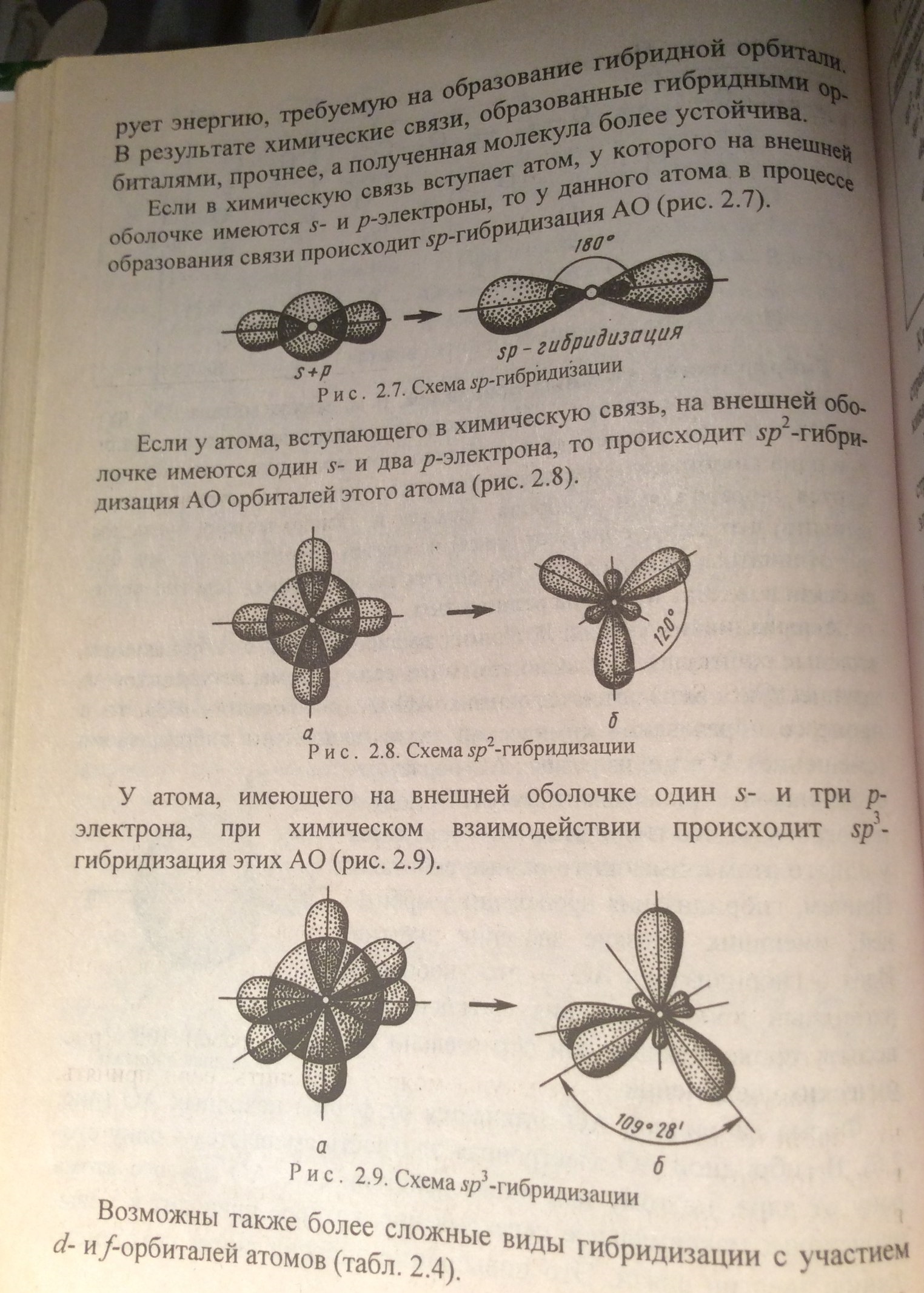
17. Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
Ионная (электровалентная) химическая связь — связь, обусловленная образованием электронных пар за счет перехода валентных электронов от одного атома к другому. Характерна для соединений металлов главных подгрупп 1 и 2 группы с наиболее типичными неметаллами (элементами главных подгрупп VI и VII групп). Поэтому к типичным соединениям с ионным типом связи относятся галогениды щелочных металлов, например NaCl, CsF.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Неполное разделение зарядов в ионных соединениях можно объяснить также взаимной поляризацией ионов, т.е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов.
Каждый ион можно характеризовать его поляризующим действием, которое зависит от напряженности создаваемого им электрического поля, пропорционального отношению заряда к радиусу, и поляризуемостью, то есть способностью их к деформации .
Поляризация тем больше, чем меньше размер катиона и больше его заряд, то есть чем больше ионный потенциал.Поэтому катионы с большим зарядом (B3+, Si 4+, P5+) образуют только ковалентные соединения.
Поляризация тем больше, чем больше отрицательный заряд аниона и больше его радиус; многозарядные анионы по этой причине образуют только ковалентные соединения . Полярность связи. Полярность молекул и дипольный момент.
Полярность химических связей – характеристика химической связи (как правило, ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи. Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда). Практически все химические связи, заисключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны.
Чем больше разница в относительной электроотрицательности атомов, тем больше полярность химической связи и дипольный момент.
Ионная (электровалентная) химическая связь — связь, обусловленная образованием электронных пар за счет перехода валентных электронов от одного атома к другому. Характерна для соединений металлов с наиболее типичными неметаллами, напр.:
Na+ + Cl— = Na + Cl
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
Дипольный
момент зависит от полярности связи,
геометрии молекул, наличия неподеленных
пар электронов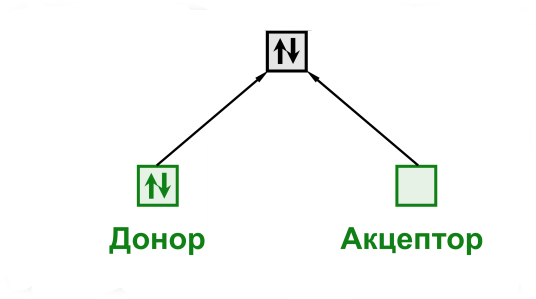 .
.
